Services on Demand
Journal
Article
Indicators
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO
Share
Ciência e Cultura
Print version ISSN 0009-6725
Cienc. Cult. vol.64 no.3 São Paulo 2012
http://dx.doi.org/10.21800/S0009-67252012000300014

Aprendendo com as interações da natureza: microrganismos simbiontes como fontes de produtos naturais bioativos
Raphael Conti
Denise O. Guimarães
Mônica T. Pupo
Em geral, os microrganismos, especialmente fungos e bactérias, são lembrados como causadores de doenças. Esta associação é natural, e, infelizmente, mesmo em uma época de tantos avanços científicos e tecnológicos, algumas infecções microbianas podem comprometer a vida de pacientes, principalmente aqueles que apresentam o sistema imunológico debilitado. Diversos microrganismos também causam doenças em alimentos, plantas e animais, levando a prejuízos significativos no agronegócio.
Esses processos patológicos e de deterioração frequentemente estão relacionados a fatores de virulência microbianos, que podem incluir substâncias químicas conhecidas como micotoxinas. Porém, microrganismos também são profícuos produtores de substâncias químicas com grande aplicação na indústria farmacêutica, pois são usadas como fármacos ou como estruturas-modelo para o planejamento e desenvolvimento de fármacos. Diversos antibióticos, anticancerígenos, imunossupressores e agentes redutores do colesterol sanguíneo, entre outros, têm suas origens em produtos naturais microbianos. Os microrganismos apresentam, portanto, uma surpreendente capacidade de produzir substâncias químicas com elevada potência biológica (1).
Todas essas substâncias químicas, com efeitos tóxicos, terapêuticos, ou mesmo sem efeito biológico conhecido, são denominadas produtos naturais. Mas, qual a razão da apreciável capacidade biossintética dos microrganismos? Diferentemente dos metabólitos primários, os produtos naturais são produzidos por razões fisiológicas específicas, sociais ou predatórias, estando, portanto, relacionados com a ecologia dos organismos produtores (2). Microrganismos estão em todos os lugares: solo, ar, água, pedras, na superfície ou no interior de outros seres vivos (plantas, animais, humanos), ambientes com condições extremas de temperatura, pH, oxigenação, entre outros. Esses microscópicos seres vivos não apresentam defesas físicas e não se locomovem, portanto precisaram desenvolver estratégias adaptativas que permitissem sua sobrevivência no ambiente.
Em um ecossistema os organismos estão constantemente interagindo entre si; tais relações podem ser intraespecíficas ou interespecíficas. Em função dos tipos de dependência que os organismos mantêm entre si, e se há prejuízo ou benefício para os organismos envolvidos, essas relações ainda são subdivididas em harmônicas e desarmônicas. Nas relações harmônicas não existe prejuízo para nenhuma das espécies envolvidas e, pelo menos uma delas, é beneficiada; já nas desarmônicas, ocorre prejuízo de uma das espécies e benefício da outra. A simbiose é uma relação interespecífica, harmônica e estável, em geral de longa duração, frequentemente encontrada nas comunidades terrestres e aquáticas, com papel fundamental no surgimento das principais formas de vida na Terra e na geração de diversidade biológica (3).
Os microrganismos surgiram e se diversificaram previamente aos macrorganismos multicelulares. Estes organismos maiores e mais complexos forneceram novos potenciais habitats ricos em nutrientes e que ainda propiciam proteção para os microrganismos. Assim, muitos microrganismos se tornaram dependentes de seus hospedeiros para a sobrevivência. Por outro lado, os compostos bioativos produzidos pelos microrganismos podem ser usados como agentes de defesa pelos hospedeiros. Como resultado, plantas, animais e humanos têm se envolvido em complexas interações com microrganismos durante sua evolução (3).
É muito provável que os produtos naturais sejam resultados das interações entre organismos entre si e destes com o ambiente, e que desempenhem funções precisas e definidas nessas associações simbióticas, representando uma das vantagens adaptativas e evolutivas para os organismos produtores. Como consequência dessa função ecológica, os produtos naturais microbianos constituem fontes promissoras para a bioprospecção de novas moléculas com potencial aplicação na medicina (fármacos), agricultura (agroquímicos) e nos estudos de processos biológicos (biologia química). De fato, a investigação de microrganismos que vivem em associações simbióticas com outros organismos (ex.: plantas, insetos, organismos marinhos, nematoides), e mesmo em associação com outros microrganismos, vem sendo cada vez mais explorada na química de produtos naturais como uma alternativa para a busca de moléculas com atividade biológica. Alguns exemplos de interações simbiontes são destacados a seguir.
MICRORGANISMOS ENDOFÍTICOS De acordo com a sanidade do hospedeiro vegetal, o material coletado para análise e a técnica de isolamento empregada, os microrganismos em relação simbiótica com as plantas são classificados em endofíticos, epifíticos, rizosféricos, entre outros (4). Os endofíticos, em geral fungos e bactérias, vivem intra e/ou extracelularmente pelo menos em um período de seu ciclo de vida, sem causar doenças aparentes ao hospedeiro (5).
A interação entre planta e endofíticos é dependente de um equilíbrio antagônico, pois microrganismos considerados como endofíticos podem ser fitopatógenos em seu estado latente (4). Verdadeiros endofíticos estão diretamente associados com a sanidade de seu hospedeiro, proporcionando-lhe benefícios através da produção, indução ou inibição de metabólitos primários e/ou secundários, com funções em controle biológico (fito-hormônios, herbicidas, antimicrobianos), regulação de estresse abiótico, biorremediadores e vetores gênicos (4;5). Porém, as relações bioquímicas entre endófitos e suas plantas hospedeiras ainda não estão totalmente esclarecidas.
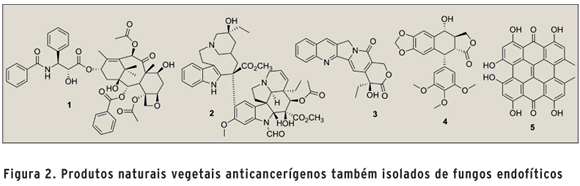
Acredita-se que os metabólitos secundários bioativos produzidos por esses microrganismos possam estar diretamente associados com a planta hospedeira através da recombinação gênica entre as espécies durante a fase evolutiva. De fato, alguns dados da literatura têm mostrado a habilidade dos fungos endofíticos de produzir in vitro metabólitos secundários idênticos aos da planta hospedeira (Figura 2) (5). O mais marcante exemplo foi o isolamento do antitumoral taxol (1) do fungo endofítico Taxomyces andreanae, associado a Taxus brevifolia (6). Mais recentemente, os produtos naturais vegetais anticancerígenos vincristina (2), camptotecina (3), podofilotoxina (4) e hipericina (5), foram também isolados de fungos endofíticos associados aos respectivos hospedeiros vegetais (5), evidenciando uma possível transferência genética de genes biossintéticos. Nesse contexto, fica evidente a importância da etnobotânica nos estudos de bioprospecção por microrganismos endofíticos. Novos produtos naturais bioativos têm sido frequentemente descritos na literatura, demonstrando a relevância desses microrganismos em programas de bioprospecção (5).
MICRORGANISMOS E ORGANISMOS MARINHOS Os mares e oceanos juntos cobrem aproximadamente 70% da superfície de nosso planeta e servem de abrigo para 34 dos 36 filos já descritos, alguns exclusivamente de ambiente marinho, e representados por aproximadamente 300 mil espécies, distribuídas entre a fauna e flora (7, 8), constituindo o maior reservatório de biodiversidade da Terra. Os diversos fatores abióticos presentes nesses ecossistemas, como a pressão, salinidade, temperatura, pH, e bióticos, como a competição por espaço, predação, incrustação da superfície e reprodução, se refletem tanto na variabilidade genética, quanto nas rotas metabólicas desses seres vivos para que possam adaptar-se ao habitat em que vivem.
Produtos bioativos marinhos são obtidos principalmente de invertebrados, macroalgas e microrganismos (9). Os microrganimos são geralmente isolados da água do mar, de sedimentos, algas, peixes e principalmente de invertebrados marinhos como esponjas, moluscos, tunicados, cnidários e crustáceos (10). Alguns produtos naturais isolados de invertebrados marinhos mostram grande semelhança estrutural com produtos naturais bacterianos, sugerindo que os microrganismos estão, no mínimo, envolvidos na sua biossíntese ou são, de fato, a verdadeira fonte desses metabólitos (11, 12, 13). Esta hipótese simbiótica tem atraído a atenção dos pesquisadores, afinal a produção em maior escala de eventuais produtos por fermentação microbiana é mais factível e de menor impacto ambiental que o isolamento de produtos naturais dos invertebrados marinhos (11).
Em alguns casos há evidências para essa hipótese, mas a complexidade das associações entre os organismos marinhos dificulta a definição da origem biossintética de muitos produtos naturais. Esponjas, por exemplo, constituem um microambiente que pode abrigar uma ampla diversidade microbiana, incluindo fungos, arqueobactérias, bactérias heterotróficas, algas, cianobactérias, criptofíceas, dinoflagelados e diatomáceas (14;15). Estes simbiontes podem estar localizados intra e/ou extracelularmente na esponja hospedeira. Especula-se que funções como aquisição de nutrientes, regulação metabólica, mecanismos de defesa e fixação de nitrogênio podem ser atribuídas às interações entre esponjas e microrganismos (12;16). Novos produtos naturais bioativos produzidos por microrganismos marinhos têm sido frequentemente relatados na literatura (17).
QUANDO A FUNÇÃO DO PRODUTO NATURAL NA RELAÇÃO SIMBIÓTICA É DESVENDADA A grande maioria dos trabalhos envolvendo microrganismos simbiontes, como aqueles associados a plantas e organismos marinhos, tem sido direcionada seguindo as estratégias experimentais tradicionais da química de produtos naturais, isto é, envolvendo o isolamento da linhagem microbiana de seu habitat, o cultivo em laboratório e a triagem dos extratos obtidos em diferentes ensaios biológicos para o isolamento e identificação dos produtos naturais bioativos. Esta abordagem permite a identificação de produtos naturais ativos, objeto da bioprospecção, porém não fornece respostas para a difícil questão que envolve as razões pelas quais os produtos naturais são biossintetizados. Trabalhos mais recentes têm sido direcionados para se determinar a função real desses produtos naturais para o microrganismo produtor. Exemplos elegantes da determinação da função ecológica de produtos naturais microbianos incluem estudos realizados com microrganismos associados a insetos. Outros trabalhos envolvendo interações entre nematoides e microrganismos e entre microrganismos, também têm determinado a função dos produtos naturais envolvidos na relação simbiótica.
MICRORGANISMOS E INSETOS Insetos, um dos filos de animais mais abundantes e complexos, abrigam um surpreendente número de microrganismos simbiontes. As formigas se destacam, representando um exemplo fascinante de interação simbiótica com microrganismos. Formigas Apterostigma dentigerum coevoluíram em um mutualismo de cerca de 50 milhões de anos com o fungo basidiomiceto Leucoagaricus sp., que é cultivado em jardins como fonte de alimento para as formigas. Porém, fungos filamentosos parasitas do gênero Escovopsis podem comprometer a viabilidade dos ninhos de formigas, devido ao efeito tóxico frente à Leucoagaricus sp. Como forma de proteção, as formigas desenvolveram estruturas especializadas em seu corpo para carregar actinobactérias, predominantemente dos gêneros Pseudonocardia e Streptomyces, responsáveis pela produção de antimicrobianos que controlam a infecção por Escovopsis sp., protegendo a fonte de alimento. Das culturas laboratoriais de Pseudonocardia spp. foi obtido o depsipeptídeo cíclico dentigerumicina (6), responsável pela inibição do fungo parasita Escovopsis sp. e de outros fungos patogênicos, mas sem toxicidade ao fungo usado para alimentação das formigas (18). Formigas cortadeiras Acromyrmex echinatior também estabelecem relação simbiótica com o fungo Leucoagaricus gongylophorus e com actinobactérias dos gêneros Pseudonocardia e Streptomyces. Antimicinas A1-A4 (7-10), valinomicina (11) e actinomicinas D e X2 (12-13) (Figura 3) foram identificadas de espécies Streptomyces em associação com as formigas cortadeiras e possuem atividade antibiótica relacionada com a proteção das formigas contra patógenos (19). Outra espécie de formiga cortadeira, Acromyrmex octospinosus, também possui relação simbiótica com fungos do gênero Leucoagaricus, e com actinobactérias do gênero Streptomyces. Diversas espécies Streptomyces spp. produziram o antibiótico macrolídeo, candicinina D (14) (Figura 3), que, juntamente com outros antibióticos produzidos por essas actinobactérias, deve auxiliar no combate aos fungos patogênicos que possam causar morte de Leucoagaricus sp. (20).
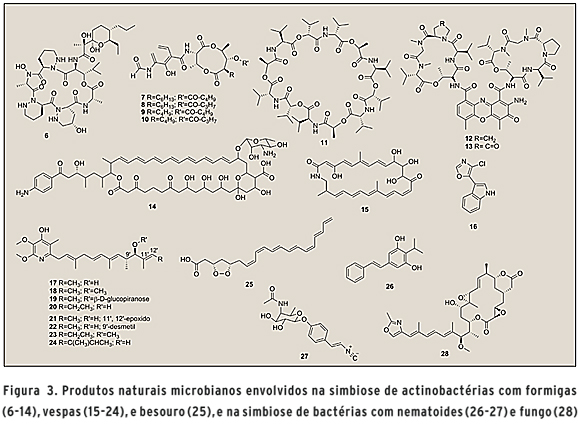
Vespas também estabelecem relações simbiônticas com microrganismos. Streptomyces sp., isolado da vespa Sceliphron caementarium, produz o polieno macrocíclico escelifolactama (15) (Figura 3), substância com atividade antifúngica frente a Candida albicans resistente à anfotericina B (21). Outros metabólitos, pertencentes a diferentes classes químicas, também foram identificados a partir da simbiose entre Streptomyces sp. e as espécies de vespas Sceliphron caementarium e Chalybion californicum (22). Vespas Philanthus spp. cultivam bactérias simbiontes específicas Streptomyces spp. que são incorporadas no casulo para proteção contra patógenos. A identificação de substâncias antibióticas produzidas por essas actinobactérias, como estreptoclorina (16), piericidina A1 (17), piericidina B1 (18), glucopiericidina A (19) piericidina A5 (20), piericidina C1 (21), 9'-demetil-piericidina A1 (22), piericidina B5 (23) e piericidina IT-143-B (24) (Figura 4), indica que essa relação favorece a garantia de sobrevivência das vespas através da proteção das larvas no casulo contra agentes patogênicos (23).
Outro estudo demonstrou que uma espécie de Streptomyces sp., simbionte do besouro Dendroctonus frontalis, é responsável pela produção da micangimicina (25) (Figura 3), que possui ação antagonista de crescimento frente ao fungo Ophiostoma minus, o qual é um competidor natural do fungo Entomocorticium sp., este último por sua vez possui importante função protetora durante o desenvolvimento de larvas do besouro Dendroctonus frontalis (24, 25).
MICRORGANISMOS E NEMATOIDES Outros metabólitos secundários com atividade biológica e possível aplicação industrial também podem ser exemplificados a partir de microrganismos encontrados em associação com nematoides. Bactérias pertencentes ao gênero Photorhabdus e Xenorhabdus vivem em associação complexa de simbiose com nematoides hospedeiros, parasitam larvas de insetos no solo e ainda enfrentam competidores microbianos. Através da relação de simbiose entre bactérias Photorhabdus e Xenohabdus com nematoides Heterorhabditis e Steinernema, respectivamente, é possível a garantia de infecção de uma ampla variedade de larvas de insetos no ambiente, e essa característica é utilizada no auxílio como controle biológico natural na agricultura. Quando um nematoide invade um inseto, ele regurgita a bactéria, esta por sua vez produz toxinas, proteases e esterases que auxiliam no combate e morte do inseto. Além disso, as bactérias produzem moléculas que auxiliarão no desenvolvimento de jovens nematoides até a fase adulta, contra a resposta imune inata dos insetos e como antibióticos contra competidores microbianos naturais. Essas funções biológicas múltiplas podem ser atribuídas aos compostos produzidos, estilbenos (26) e isocianetos vinílicos, como a rabduscina (27) (Figura 3) (26).
MICRORGANISMOS E MICRORGANISMOS Outro tipo de associação que tem levado à caracterização funcional de produtos naturais é estudo de simbiose entre dois microrganismos. A substância rizoxina (28) (Figura 3), com propriedades anticâncer, é produzida pela bactéria Burkholderia rhizoxinica, encontrada em associação simbiótica com o fungo Rhizopus microsporus. Nessa relação ambos beneficiam da ação fitopatogênica da rizoxina contra o arroz que, durante estágio de morte, serve como alimento para a bactéria e para o fungo. Além disso, a bactéria ganha proteção dentro das células fúngicas com condições favoráveis de metabolismo citosólico e o fungo necessita da bactéria para garantir sua esporulação, enquanto garante sua resistência à toxicidade da rizoxina via mutações genéticas em genes da tubulina, alvo de mecanismo geral para ação dessa toxina (26).
CONCLUSÕES É clara a relevância da inclusão de microrganismos em programas de bioprospecção. Atenção especial deve ser dirigida aos microrganismos simbiontes, que produzem diversos produtos naturais ainda desconhecidos e envolvidos em funções ecológicas, sendo, portanto, candidatos promissores para a descoberta de moléculas com aplicações terapêuticas e/ou agroquímicas. É provável que muitos dos microrganismos em comunidades naturais sejam obrigatoriamente dependentes de outras espécies de organismos (3), o que explicaria a razão pela qual o cultivo em laboratório de cerca de 99% dos microrganismos seja difícil ou impossível. Neste sentido, a metagenômica e as técnicas modernas de biologia molecular despontam como alternativas para acessar o genoma dessa microbiota e, consequentemente, o amplo arsenal químico que ainda permanece escondido na biodiversidade microbiana. Porém, o sucesso de projetos na área depende de trabalho integrado entre químicos, biólogos e farmacêuticos, com conhecimentos nas áreas de química orgânica, química analítica, química medicinal, farmacologia, microbiologia, biologia molecular, ecologia, entomologia, botânica, meio ambiente, entre outros. No Brasil, o número de grupos de pesquisa que se dedica ao estudo de produtos naturais microbianos vem aumentando significativamente. Com trabalho integrado entre as diversas expertises pode-se vislumbrar um futuro promissor que possibilitará a descrição das funções de produtos naturais microbianos na mediação de interações simbiônticas e, concomitantemente, a descoberta de novas moléculas úteis para o planejamento de fármacos e agroquímicos.
Raphael Conti é doutorando em ciências pelo Programa de Pós-Graduação em Ciências Farmacêuticas da Faculdade de Ciências Farmacêuticas de Ribeirão Preto, Universidade de São Paulo (FCFRP-USP), Ribeirão Preto, SP. Email: raphael.conti@gmail.com.
Denise O. Guimarães é doutora em ciências pelo Programa de Pós-Graduação em Ciências Farmacêuticas FCFRP-USP e professora adjunta do curso de farmácia, Universidade Federal do Rio de Janeiro, Macaé, RJ . Email: denise@macae.ufrj.br.
Mônica T. Pupo é doutora em ciências pelo Programa de Pós-Graduação em Química do DQ-UFS-Car, professora associada da FCFRP-USP e bolsista do CNPq, Ribeirão Preto, SP . Email: mtpupo@fcfrp.usp.br.
NOTAS E REFERÊNCIAS BIBLIOGRÁFICAS
1. Lopes, A. A.; Guimarães, D. O.; Pupo, M.T. Ciência Hoje Vol.286, no.30. 2011.
2. O'Brien, J.; Wright, G.D. Curr. Op. Biotechnol. Vol.22, no.552. 2011.
3. Moran, N.A. Curr. Biol. Vol.16, R866, 2006.
4. Selosse, M.A.; Baudoin, E.; Vandenkoornhuyse, P.C.R. Biol. Vol.327, no.639. 2004.
5. Borges, W. S.; Borges, K.B.; Bonato, P. S.; Said, S.; Pupo, M. T. Curr. Org. Chem. Vol.13, no.1137. 2009.
6. Stierle, A.; Strobel, G.; Stierle, D. Science, Vol.260, no.214. 1993.
7. Faulkner, D.J. Nat. Prod. Rep. Vol.18, no.1. 2001.
8. Arrieta, J.M.; Arnaud-Haond, S.; Duarte, C.M. Proc. Natl. Acad. Sci. U. S. A. Vol.107, no.18318. 2010.
9. Bhatnagar, I.; Kim, S.K. Mar. Drugs Vol.8, no.2673. 2010.
10. Kelecom, A. An. Acad. Bras. Cienc. Vol.74, no.151. 2002.
11. Piel, J. Curr. Med. Chem. Vol.13, no.39. 2006.
12. Taylor, M. W.; Radax, R.; Steger, D.; Wagner, M. Microbiol. Mol. Biol. Rev. Vol.71, no.295. 2007.
13. Thomas, T.R.A.; Kavlekar, D.P.; Lokabharathi, P.A. Mar. Drugs. Vol.8, no.1417. 2010.
14. Lee, Y. K.; Lee, J.H.; Lee, H.K. J. Microbiol. Vol.39, no.254. 2001.
15. Li, Z. Mar. Drugs. Vol.7, no.113. 2009.
16. Webster, N. S.; Taylor, M.W. Environ. Microbiol. (doi:10.1111/j.1462-2920. 2011.02460.x.), 2011.
17. Bhatnagar, I.; Kim, S.-K., Mar. Drugs Vol.8, no.2673. 2010.
18. Oh, D.-C.; Poulsen, M.; Currie, C.R.; Clardy, J. Nat. Chem. Biol. Vol.5, no.391. 2009.
19. Schoenian, I.; Spieteller, M.; Ghaste, M.; Wirth, R.; Herz, H.; Spiteller, D. Proc. Natl. Acad. Sci. U. S. A. Vol.108, no.1955. 2011.
20. Haeder, S.; Wirth, R.; Herz, H.; Spiteller, D. Proc. Natl. Acad. Sci. U. S. A. Vol.106, no.4742. 2009.
21. Oh, D.-C.; Poulsen, M.; Currie, C.R.; Clardy, J. Org. Lett. Vol.13, no.752. 2011.
22. Poulsen, M.; Oh, D.-C.; Clardy, J.; Currie, C.R. PLoS One 6, e16763. 2011.
23. Kroiss, J.; Kaltenpoth, M.; Schneider, B.; Schwinger, M.-G.; Hertweck, C.; Maddula, R.K.; Strhm, E.; Svatos, A. Nat. Chem. Biol. Vol.6, no.261. 2010.
24. Scott, J.; Oh, D.-C.; Yuceer, M.C.; Klepzig, K.D.; Clardy, J. Science Vol.322, no.63. 2008.
25. Oh, D.-C.; Scott, J.J.; Currie, C.R.; Clardy, J. Org. Lett. Vol.11, no.633. 2009.
26. Crawford, J. M.; Clardy, J. Chem. Commun. Vol.47, no.7559. 2011.