Services on Demand
Journal
Article
Indicators
Related links
-
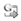 Cited by Google
Cited by Google -
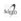 Similars in
SciELO
Similars in
SciELO
Share
Ciência e Cultura
On-line version ISSN 2317-6660
Cienc. Cult. vol.66 no.1 São Paulo 2014
http://dx.doi.org/10.21800/S0009-67252014000100015

Relação entre estresse oxidativo, alterações epigenéticas e câncer
Camila Tainah da Silva
Miriam Galvonas Jasiulionis
Quando respiramos fornecemos a todas as células do nosso corpo oxigênio necessário para produzir energia através de um processo conhecido como metabolismo oxidativo. Em suma, o oxigênio é reduzido e as ligações covalentes da glicose são quebradas liberando gás carbônico, água e energia. A principal organela celular envolvida é a mitocôndria, onde atuam diversas enzimas responsáveis por catalisar as etapas desse processo. Em cada uma dessas etapas há a formação de subprodutos que, em sua maioria, são benéficos. No entanto, aproximadamente 5% podem ser tóxicos para a célula quando em altas concentrações.
O oxigênio, por exemplo, durante o transporte de elétrons na mitocôndria pode ser reduzido parcialmente gerando espécies reativas de oxigênio (EROs), tais como ânion superóxido (O2-), peróxido de hidrogênio (H2O2) e radical hidroxila (OH-). Quando ocorre a perda do equilíbrio entre produção e eliminação de EROs, o que é chamado de estresse oxidativo, podem ocorrer danos ao DNA, RNA, lipídios e proteínas. Além de fragmentação do DNA, as EROs podem causar o mal funcionamento do sistema de reparo do DNA, contribuindo para o desenvolvimento de doenças, como o câncer (1).
ANTIOXIDANTES, ALIMENTAÇÃO E FATORES AMBIENTAIS A célula conta com um arsenal de antioxidantes para a manutenção da homeostasia oxidativa (Figura 1). Eles fazem parte do sistema de defesa e podem ser produzidos pela própria célula (glutationa ou GSH, ácido alfa-lipoico, coenzima Q, ferritina, ácido úrico, bilirrubina, etc) ou obtidos pela dieta (ácido ascórbico ou vitamina C, tocofenol ou vitamina E, betacaroteno ou vitamina A, etc). Existem ainda os antioxidantes enzimáticos (superóxido dismutase ou SOD, catalase ou CAT, glutationaperoxidase, etc), que atuam na produção ou eliminação das EROs.
A qualidade dos alimentos ingeridos pode influenciar no estado oxidativo das células. A ingestão de frutas e vegetais, ricos em vitaminas, aumenta o potencial antioxidante, principalmente no sangue (2). A vitamina C é um dos principais antioxidantes oriundos da dieta. Os níveis de ingestão recomendados para a dieta são de 75 a 125 mg por dia, dependendo de características individuais, como idade, peso e sexo. O consumo exagerado de vitamina C é desnecessário, já que o máximo de absorção é de aproximadamente 200 mg por dia (3). Entre os alimentos ricos em vitamina C estão a goiaba, o caju, a laranja, a manga, entre outros.
A prática de exercícios físicos está relacionada ao aumento e ativação de enzimas antioxidantes, por exemplo, a SOD, levando à redução dos níveis de EROs. Já foi mostrado que a prática regular de exercícios físicos pode atuar retardando o envelhecimento e reduzindo o risco de doenças cardiovasculares (4). No entanto, a prática deve ser moderada em quantidade e intensidade, já que os níveis de EROs podem aumentar durante exercícios muito intensos, principalmente quando realizados de maneira não periódica (5).
Um bom exemplo de fator ambiental que leva ao desbalanço oxidativo para o lado danoso é a poluição do ar. As partículas inaladas geram resposta inflamatória nos alvéolos, podendo até mesmo causar inflamação sistêmica com efeitos cardiovasculares. Partículas geradas por reações de combustão são altamente oxidantes e causam grandes danos ao serem inaladas por seres humanos e animais (6).
A obesidade, que representa um crescente problema de saúde pública, parece ter uma relação mútua com o estresse oxidativo. Se, por um lado, o aumento de EROs pode ser um pré fator para a obesidade, por outro as citocinas inflamatórias geradas pela própria doença também levam ao aumento de EROs, criando um círculo vicioso. O estresse oxidativo estabelecido pode também contribuir com o desenvolvimento de outras doenças crônicas, como resistência à insulina e síndrome metabólica (7).
O estresse psicológico crônico também é fonte de EROs. Como tentativa para recuperar o balanço homeostático, o sistema nervoso autônomo, sistema renina-angiotensina e eixo hipotálamo-hipófise-adrenal são estimulados. A ativação prolongada dessas vias pode resultar em disfunção imune crônica e no aumento da produção de EROs, com consequentes danos ao DNA. Tais processos podem contribuir, por exemplo, para o envelhecimento precoce da pele (8).
FUNÇÕES FISIOLÓGICAS CONTROLADAS POR EROS É importante lembrar que diversas funções fisiológicas são controladas por vias que envolvem sinalização redox (aquelas envolvidas em reações de troca de elétrons por redução e oxidação, como no caso da produção de O2-). Um exemplo é a produção aumentada de EROs por leucócitos durante os processos inflamatórios, representando uma importante defesa contra patógenos. Também se observa a participação de EROs em processos que envolvem adesão celular, como embriogênese, diferenciação, reparo e cicatrização. A apoptose, morte celular programada que regula o tempo de vida de células normais, pode ser induzida por danos ao DNA causados por EROs (9). Esses são apenas alguns dos exemplos em que a presença de concentrações adequadas de EROs pode ser importante para a manutenção de estados celulares normais.
A participação do estresse oxidativo no envelhecimento também já é bem conhecida. O envelhecimento se trata de um evento multifatorial que acontece depois da fase reprodutiva da vida, onde se observa um progressivo declínio das funções fisiológicas do organismo. Uma das teorias é baseada no fato de que danos celulares causados por EROs são cumulativos e deletérios ao longo do tempo. Um dado interessante é que danos oxidativos no DNA podem ser monitorados pela urina e foi observado que a composição da dieta pode modular esses danos. A longevidade poderia, portanto, ser dependente não apenas de fatores intrínsecos, como hereditariedade, mas também de fatores externos, como a dieta e a prática de exercícios físicos (9).
ESTRESSE OXIDATIVO, EPIGENÉTICA E CÂNCER Entre os processos patológicos em que já foi descrita a participação do estresse oxidativo estão as doenças cardiovasculares, neurológicas, o diabetes e o câncer. Diversos tumores humanos, incluindo melanoma, leucemias, carcinomas gástrico, prostático, mamário e de cólon, apresentam níveis elevados de EROs (10). Células tumorais estão comumente expostas a condições de estresse, como hipóxia (baixos níveis de oxigênio), perda de adesão célula-célula e célula-matriz extracelular, desbalanço no metabolismo oxidativo e diversos fatores ambientais (11).
As EROs são reguladores de diversas vias de transdução de sinais, podendo participar de diversas etapas da transformação e progressão tumoral, como a autossuficiência em sinais de crescimento, insensibilidade a sinais antiproliferativos, evasão da apoptose, potencial replicativo ilimitado, angiogênese sustentada, invasão e metástase, metabolismo e inflamação (12).
Dentre as vias reguladas por EROs destacam-se a das proteínas quinase ativada por mitógeno (MAPK) e fosfoinositídeo-3-quinase(PI3K). A primeira possui papel importante na tumorigênese, principalmente por ativar fatores de transcrição como c-Jun e c-Fos, que regulam a expressão de genes envolvidos em proliferação celular, diferenciação, transformação, inflamação, entre outros (11). Já a PI3K está relacionada à via de RAS, que possui papel fisiológico importante na sobrevivência celular. No entanto, diversos mecanismos podem levar a sua desregulação, contribuindo diretamente para o desenvolvimento de tumores (13).Outra função já descrita do estado oxidativo no controle da viabilidade celular é a regulação do ciclo celular. Antes da mitose, a célula passa por um processo de checagem do DNA para averiguar possíveis danos e, se necessário, realizar seu reparo. Uma proteína de papel fundamental nessa etapa é a quinase ataxia-telangiectasiamutada (ATM), da mesma família da PI3K. Apesar de sua principal função ser responder à quebra na dupla fita do DNA, alguns estudos mostram que ela também pode ser ativada pelo estresse oxidativo. Nessa situação, ela ativa uma das principais proteínas reguladoras do metabolismo oxidativo, p53, que está relacionada a inúmeros tipos de tumores (14) (Figura 2).
Infecções virais podem ser fonte de estresse oxidativo para células hospedeiras e, em alguns casos, contribuir para o desenvolvimento do câncer. O vírus da hepatite C (HCV), por exemplo, desencadeia uma série de respostas celulares mediadas por EROs, representando risco para doenças hepáticas, como esteatose, cirrose e carcinoma hepatocelular. Algumas das vias envolvidas parecem ser as mesmas descritas anteriormente (MAKP e PI3K) (15). De forma semelhante, o vírus do papiloma humano (HPV), fator de risco para o câncer de colo de útero, parece também levar ao desbalanço de EROs nas células hospedeiras. O estresse oxidativo poderia agir em sinergia com o HPV, criando condições ideais para a iniciação e a progressão tumoral (16).
Um elo muito interessante entre ambiente e estresse oxidativo no processo de carcinogênese é a epigenética. O termo epigenética foi criado há aproximadamente 70 anos na tentativa de explicar os múltiplos fenótipos celulares oriundos de um mesmo genótipo. O conceito clássico define epigenética como mudanças químicas na cromatina que não envolvem mudanças na sequência de nucleotídeos do DNA. Hoje o termo tomou proporções maiores e compreende diversos mecanismos que participam da regulação de expressão gênica, tais como metilação de DNA, modificações pós-traducionais em histonas, RNAs não codificadores, entre outros. Um fato que desperta muito interesse nos cientistas é que os processos epigenéticos são potencialmente reversíveis, diferente de alterações genéticas, e são consequentemente passíveis de tratamento (17).
A metilação do DNA é um dos mecanismos epigenéticos mais bem estudados até hoje. Trata-se da adição de um grupamento metila no carbono 5 de citosinas adjacentes a guaninas (dinucleotídeosCpG). A metilação em promotores está associada ao silenciamento gênico. Diversas regiões gênicas que se encontram silenciadas por metilação em células normais, como por exemplo transposons, tornam-se frequentemente desmetiladas no câncer (18).
Os promotores gênicos, regiões regulatórias localizadas próximas ao sítio de início de transcrição, servem como sítio de ligação para fatores transcricionais e para a RNA polimerase. Aproximadamente 60% dos genes humanos apresentam alta concentração de dinucleotídeos CpG, ilhas de CpGs, em seus promotores. Nessas regiões, a metilação do DNA tem papel importante, já que define o status de transcrição gênica. De maneira geral, promotores contendo ilha de CpGs não metilada são passíveis de transcrição, enquanto que promotores metilados são transcricionalmente inativos (19). Em células tumorais, muitos promotores de genes supressores tumorais tornam-se metilados, resultando em seu silenciamento e contribuindo com a perda do controle celular.
Fatores ambientais podem regular diretamente mecanismos epigenéticos. O folato, importante substrato para reações de metilação (incluindo a do DNA), deve ser adquirido pela alimentação, já que nossas células não o sintetizam. Outro cofator fundamental é a S-adenosilmetionina (SAM), também essencial para a manutenção dos padrões de metilação das células. Tanto o folato quanto a SAM participam do ciclo da metionina e este está intimamente relacionado com o estado oxidativo da célula. A produção de glutationa (GSH), antioxidante mencionado anteriormente, está conectada bioquimicamente a essa via. A homocisteína é o subproduto gerado pela metilação de DNA e está relacionada com aumento de estresse oxidativo (20).
ESTRESSE OXIDATIVO, ALTERAÇÕES EPIGENÉTICAS E MELANOMA O melanoma é um tipo de câncer de pele proveniente da transformação maligna de melanócitos, células responsáveis pela produção de melanina. Sua incidência é baixa quando comparada com a de outros tipos de tumores de pele, representando apenas 4% destes, mas é o mais letal de todos eles. Além disso, a incidência do melanoma tem aumentado mais do que qualquer outro tipo de câncer (21). Embora apresente taxa de sobrevida maior que 90% quando detectado precocemente, esta diminui para 60% em formas mais avançadas como melanoma estágio II, para 10% em melanoma estágio III, ou até para completa fatalidade em casos de melanoma estágio IV. Esse panorama reflete a falta de tratamentos para melanomas avançados (22).
O estresse causado por agentes como radiação ultravioleta (UV) e inflamação crônica é um importante fator de risco para o desenvolvimento de tumores de pele, incluindo o melanoma (23). Diversos autores já mostraram que os níveis de EROs estão elevados no melanoma (24-25). Apesar de melanócitos conseguirem suprimir o aumento de EROs, o melanoma não possui essa habilidade (26). As células de melanoma possuem redução nos níveis de glutationa e da atividade das enzimas CAT e SOD (27-28). Já foi observado que o aumento nos níveis de O2- e diminuição de H2O2 eleva o potencial proliferativo e também a resistência ao tratamento quimioterápico (29).
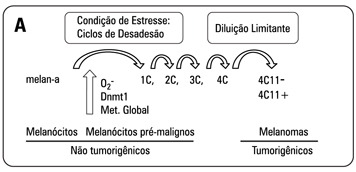
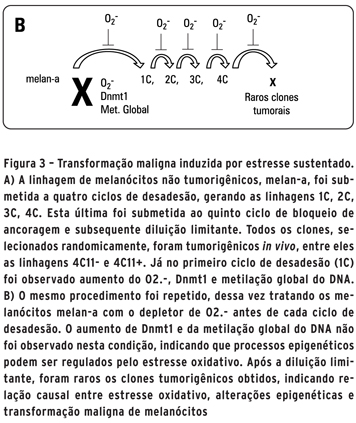
A exposição à radiação UV representa um dos principais fatores de risco para o desenvolvimento do melanoma, causando importantes alterações genéticas e epigenéticas (30). Pode causar estresse oxidativo, inflamação, eritema, quebra da matriz extracelular, enrugamento e câncer de pele. No entanto, poucos estudos foram feitos até hoje para entender a conexão entre estresse oxidativo e alterações epigenéticas nessa doença. Um dos motivos é a falta de material biológico em estágios iniciais do melanoma, onde é possível observar as primeiras alterações metabólicas e epigenéticas das células. Além disso, entender e diagnosticar os primeiros eventos da transformação é de suma importância, já que nessa fase as chances de sobrevida são grandes. Nosso grupo de pesquisa da Universidade Federal de São Paulo (Unifesp) desenvolveu um modelo linear de progressão do melanoma a partir de melanócitos murinos, denominados melan-a (31). Tais melanócitos foram submetidos a um ciclo de bloqueio de adesão por 96 horas em placas contendo agarose para impedir o contato célula-matriz. A maioria das células morreu por um processo conhecido como anoikis (apoptose por falta de contato célula-matriz). As poucas células sobreviventes foram plaqueadas em condições aderentes, ou seja, em placas que há contato entre célula e matriz. Essas células foram chamadas de 1C. O ciclo de desadesão e adesão foi repetido por mais três vezes, gerando as linhagens 2C, 3C e 4C e no quinto ciclo de desadesão foi realizada diluição limitante dos esferóides sobreviventes para obtenção de populações clonais. Diversos clones, entre eles os nomeados 4C11- e 4C11+, foram injetados em camundongos singenéicos e todos se mostraram tumorigênicos. Desta forma, obtivemos um modelo linear de progressão do melanoma, representado por melanócitos não tumorais (melan-a), pré-malignos (1C a 4C), tumorais não metastáticos (4C11-) e metastáticos (4C11+) (32).

Nesse modelo, constatamos níveis aumentados de EROs (como o O2-), de metilação global do DNA e da enzima DNA metiltransferase 1 (Dnmt1), responsável por catalisar a metilação do DNA, desde as primeiras horas do primeiro ciclo de bloqueio de adesão dos melanócitos (33) (Figura 3A).
O tratamento dos melanócitos melan-a antes de cada ciclo de bloqueio de adesão com agente desmetilante de DNA (5-aza-2'-deoxicitidina) ou com depletor de O2- (Mn(III)TBAP) resultou no comprometimento evidente da transformação maligna. Isso sugere que tanto o estresse oxidativo quanto as alterações na metilação do DNA são eventos iniciais e fundamentais para a transformação maligna dos melanócitos. O tratamento com o depletor de O2- durante o processo de desadesão impede tanto o aumento de Dnmt1 quanto da metilação global do DNA, sugerindo que essas alterações epigenéticas podem ser reguladas pelo estresse oxidativo (Figura 3b) (34). Essa hipótese já havia sido sugerida por Johnstone e Baylin (35) e Hitchler e Domann (20), importantes pesquisadores da área de epigenética. Os mecanismos pelos quais o estresse oxidativo regula as alterações epigenéticas encontram-se em investigação em nosso laboratório na Unifesp.
TERAPIA Trabalhos científicos têm mostrado diversos benefícios do uso de terapias antioxidantes para o tratamento de doenças como Alzheimer, diabetes e câncer. Grande parte desses estudos mostra a importância de nutrientes oriundos da alimentação. O selênio, por exemplo, pode ser incorporado em algumas proteínas evitando sua oxidação, ou seja, possui função antioxidante. Estudos mostram que o selênio tem efeitos antitumorais, prevenindo angiogênese e metástase em câncer de mama, próstata, colorretal, melanoma, fígado, pulmão, entre outros (36).
O alho é conhecido por possuir diversos compostos antioxidantes e já foi relacionado com a prevenção do câncer. Seus componentes podem afetar diversos processos celulares, como proliferação e diferenciação. O tratamento de células tumorais com alguns desses compostos, incluindo o próprio selênio, foi eficaz em inibir seu crescimento e ainda aumentar sua taxa de apoptose (37).O chá verde também é utilizado pela medicina popular para diversos fins terapêuticos. Dentre seus compostos, há antioxidantes que podem proteger a pele contra danos causados por radiação ultravioleta quando aplicados topicamente, ou seja, sobre a pele. Foi proposto que tais efeitos fotoprotetores são mediados por interações com moléculas envolvidas em respostas inflamatórias (38).
Apesar dos dados serem promissores, muito cuidado deve ser tomado no que se refere a terapias com antioxidantes não obtidos pela dieta, por exemplo, por fármacos. Alguns ensaios clínicos randomizados mostram falhas no tratamento com o uso da vitamina E, que para o tratamento de diabetes não apresentou nenhum efeito (39). Além disso, a suplementação com vitamina E resultou em aumento do risco de câncer de pulmão em fumantes (40). Estudos comparativos mostram que antioxidantes oriundos da dieta e da prática de exercícios físicos são mais eficazes para os tratamentos testados do que qualquer outra intervenção farmacológica (41).
CONCLUSÃO E PERSPECTIVAS Fatores ambientais ajudam a modular os níveis de EROs celulares dependendo de sua natureza pró ou antioxidante. Estudos apontam a participação do estresse oxidativo em diversas doenças, como o câncer, especialmente em etapas iniciais (33). Já se sabe que inúmeras vias de sinalização intracelulares ligadas ao câncer são reguladas por EROs, mas ainda pouco se sabe como evitar os danos causados pelo seu excesso. Os antioxidantes são alvo de estudo terapêutico na prevenção e cura do câncer, apesar de não haver ainda um completo consenso sobre seu uso. A inter-relação do estresse oxidativo com a epigenética também é de grande interesse, já que ambos parecem estar intimamente conectados com processos de progressão tumoral. Há, certamente, um grande campo a ser estudado, no que se refere a uma melhor compreensão de todos os mecanismos reguladores e regulados pelo estresse oxidativo e sua possível aplicação em prevenção, diagnóstico precoce e tratamento do câncer.
Camila Tainah da Silva é biotecnologista, mestre em ciências e doutoranda do Departamento de Farmacologia da Universidade Federal de São Paulo (Unifesp).
Miriam Galvonas Jasiulionis é biomédica, doutora em ciências e professora adjunta do Departamento de Farmacologia da Unifesp. Email: mjasiulionis@gmail.com
REFERÊNCIAS BIBLIOGRÁFICAS
1. Sosa, V. et al. "Oxidative stress and cancer: an overview". Ageing Res Rev, vol. 12, nº 1. 2013.
2. Wahlqvist, M.L. "Antioxidant relevance to human health". Asia Pac J Clin Nutr, vol. 22, nº 2. 2013.
3. Harrison, F.E. "A critical review of vitamin C for the prevention of age-related cognitive decline and Alzheimer's disease". J Alzheimers Dis, vol. 29, nº 4. 2012.
4. Corbi, G. et al. "Is physical activity able to modify oxidative damage in cardiovascular aging?". Oxid Med Cell Longev, vol. 2012. 2012.
5. Cardoso, A.M. et al. "Acute effects of resistance exercise and intermittent intense aerobic exercise on blood cell count and oxidative stress in trained middle-aged women". Braz J Med Biol Res, vol. 45, nº 12. 2012.
6. Miller, M.R.; Shaw, C.A.; Langrish, J.P.. "From particles to patients: oxidative stress and the cardiovascular effects of air pollution". Future Cardiol, vol. 8, nº 4. 2012.
7. Lubrano, C. et al. "Obesity and metabolic comorbidities: environmental diseases?". Oxid Med Cell Longev, vol. 2013. 2013.
8. Dunn, J.H.; Koo, J. "Psychological stress and skin aging: a review of possible mechanisms and potential therapies". Dermatol Online J, vol. 19, nº 6. 2013.
9. Valko, M. et al. "Free radicals and antioxidants in normal physiological functions and human disease". Int J Biochem Cell Biol, vol. 39, nº 1. 2007.
10. Reuter, S. et al. "Oxidative stress, inflammation, and cancer: how are they linked?". Free Radic Biol Med, vol. 49, nº 11. 2010.
11. Dhillon, A.S. et al. "MAP kinase signalling pathways in cancer". Oncogene, vol. 26, nº 22. 2007.
12. Hanahan, D.; Weinberg, R.A. "Hallmarks of cancer: the next generation". Cell, vol. 144, nº 5. 2011.
13. Takashima, A.; Faller, D.V.. "Targeting the RAS oncogene". Expert Opin Ther Targets, vol. 17, nº 5. 2013.
14. Menendez, J.A. et al. "Metformin and the ATM DNA damage response (DDR): accelerating the onset of stress-induced senescence to boost protection against cancer". Aging (Albany NY), vol. 3, nº 11. 2011.
15. Ke, P.Y.; Chen, S.S.. "Hepatitis C virus and cellular stress response: implications to molecular pathogenesis of liver diseases". Viruses, vol. 4, nº 10. 2012.
16. De Marco, F. "Oxidative stress and HPV carcinogenesis". Viruses, vol. 5, nº 2. 2013.
17. Yang, X. et al. "Targeting DNA methylation for epigenetic therapy". Trends Pharmacol Sci, vol. 31, nº 11. 2010.
18. Robertson, K.D.; Jones, P.A. "DNA methylation: past, present and future directions". Carcinogenesis, vol. 21, nº 3. 2000.
19. Jones, P.A.; Liang, G.. "Rethinking how DNA methylation patterns are maintained". Nat Rev Genet, vol. 10, nº 11. 2009.
20. Hitchler, M.J.; Domann, F.E.. "An epigenetic perspective on the free radical theory of development". Free Radic Biol Med, vol. 43, nº 7. 2007.
21. Trotter, S.C. et al. "A global review of melanoma follow-up guidelines". J Clin Aesthet Dermatol, vol. 6, nº 9. 2013.
22. Mueller, D.W.; Bosserhoff, A.K.. "Role of miRNAs in the progression of malignant melanoma". Br J Cancer, vol. 101, nº 4. 2009.
23. Irani, K. et al. "Mitogenic signaling mediated by oxidants in Ras-transformed fibroblasts". Science, vol. 275, nº 5306. 1997.
24. Melo, F.H. et al. "Endothelial nitric oxide synthase uncoupling as a key mediator of melanocyte malignant transformation associated with sustained stress conditions". Free Radic Biol Med, vol. 50, nº 10. 2011.
25. Yamaura, M. et al. "NADPH oxidase 4 contributes to transformation phenotype of melanoma cells by regulating G2-M cell cycle progression". Cancer Res, vol. 69, nº 6. 2009.
26. Meyskens, F.L., Jr. et al. "Luminol-enhanced chemiluminescent response of human melanocytes and melanoma cells to hydrogen peroxide stress".Pigment Cell Res, vol. 10, nº 3. 1997.
27. Borrello, S.; De Leo, M.E.; Galeotti, T.. "Defective gene expression of MnSOD in cancer cells". Mol Aspects Med, vol. 14, nº 3. 1993.
28. Picardo, M. et al. "Correlation between antioxidants and phototypes in melanocytes cultures. A possible link of physiologic and pathologic relevance". J Invest Dermatol, vol. 113, nº 3. 1999.
29. Pervaiz, S.; Clement, M.V.. "Superoxide anion: oncogenic reactive oxygen species?". Int J Biochem Cell Biol, vol. 39, nº 7-8. 2007.
30. Pfeifer, G.P.; Besaratinia, A.. "UV wavelength-dependent DNA damage and human non-melanoma and melanoma skin cancer". Photochem Photobiol Sci, vol. 11, nº 1. 2012.
31. Bennett, D.C.; Cooper, P.J.; Hart, I.R. "A line of non-tumorigenic mouse melanocytes, syngeneic with the B16 melanoma and requiring a tumour promoter for growth". Int J Cancer, vol. 39, nº 3. 1987.
32. Oba-Shinjo, S.M. et al. "Melanocyte transformation associated with substrate adhesion impediment". Neoplasia, vol. 8, nº 3. 2006.
33. Campos, A.C. et al. "Oxidative stress modulates DNA methylation during melanocyte anchorage blockade associated with malignant transformation". Neoplasia, vol. 9, nº 12. 2007.
34. Molognoni, F. et al. "Ras and Rac1, frequently mutated in melanomas, are activated by superoxide anion, modulate Dnmt1 level and are causally related to melanocyte malignant transformation". Plos one, in press. 2013.
35. Johnstone, S.E.; Baylin, S.B. "Stress and the epigenetic landscape: a link to the pathobiology of human diseases?". Nat Rev Genet, vol. 11, nº 11. 2010.
36. Chen, Y.C.; Prabhu, K.S.; Mastro, A.M. "Is selenium a potential treatment for cancer metastasis?". Nutrients, vol. 5, nº 4. 2013.
37. Capasso, A. "Antioxidant action and therapeutic efficacy of Allium sativum L". Molecules, vol. 18, nº 1. 2013.
38. OyetakinWhite, P.;Tribout, H.; Baron, E. "Protective mechanisms of green tea polyphenols in skin". Oxid. Med. Cell Longev., vol. 2012. 2012.
39. Suksombonn N, et al. " Effects of vitamin E supplementation on glyacaemic control in type 2 diabetes: systematic review of randomized controlled trials". J. Clin. Pharm. Ther., vol 36. 2011.
40. The Alpha-Tocopherol Beta Carotene Cancer Prevention Study Group (No autors listed). "The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers". N. Engl. J. Med., vol 330.1994.
41. Naviaux, R.K. "Oxidative shielding or oxidative stress?".J. Pharmacol. Exp. Ther., vol. 342, nº 3. 2012.