Services on Demand
Journal
Article
Indicators
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO
Share
Ciência e Cultura
Print version ISSN 0009-6725On-line version ISSN 2317-6660
Cienc. Cult. vol.56 no.1 São Paulo Jan./Mar. 2004
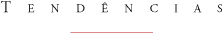
DESAFIOS DA FISIOLOGIA CELULAR NA ERA PÓS-GENÔMICA
Célia Regina da Silva Garcia
Entender a fisiologia das células e a participação dos genes no seu funcionamento representa um dos atuais desafios da ciência na era pós-genômica. O seqüenciamento do genoma do Plasmodium, protozoário causador da malária, foi finalizado em 2002. No entanto, a complexidade dos parasitas da malária e de suas interações com seu hospedeiro humano, associada a sutis mudanças no aspecto genético do parasita, requer o conhecimento da fisiologia integrativa. O surgimento de parasitas resistentes a maior parte das drogas anti-maláricas disponíveis é um dos principais problemas no tratamento da doença. Nesse âmbito, o conhecimento da dinâmica das complexas interações parasita-hospedeiro, bem como dos seus componentes moleculares, pode trazer novas direções para a elaboração de novos quimioterápicos.
Dados da Organização Mundial da Saúde estimam cerca de 300 a 500 milhões de casos clínicos anuais (90% concentrados na África), dos quais 2,7 milhões resultam em mortes. No Brasil, em 1999, foram registrados mais de 600 mil casos, constituindo-se em sério obstáculo ao desenvolvimento sócio-econômico da região Norte que, pela sua biodiversidade, deveria ser justamente um pólo de atração de pesquisadores nacionais e internacionais. Apesar dos numerosos esforços direcionados para seu controle, a malária é uma das infecções mais severas nos trópicos e está atingindo outras áreas do mundo. O ciclo de reprodução do parasita inicia-se quando, ao picar um indivíduo para se alimentar com cerca de cinco picolitros de sangue, a fêmea dos mosquitos do gênero Anopheles injeta através da saliva alguns esporozoítas que, uma vez lançados na corrente sanguínea, irão se alojar nos hepatócitos, iniciando um ciclo de reprodução assexuada, conhecido como ciclo pré-eritrocítico. Nesse período, que dura cerca de 10 dias, são produzidos e lançados de volta, na corrente sangüínea, milhares de merozoítos que irão invadir os eritrócitos, dando origem ao ciclo eritrocítico. Nessa fase ocorre a manifestação da doença e o parasita passa por três estágios de maturação bem definidos e conhecidos como: anel, trofozoíto e esquizonte. Após o ciclo de maturação, que resulta na formação de merozoítos, a célula hospedeira se rompe liberando os merozoítos na corrente sangüínea para invasão de novos eritrócitos e início de um novo ciclo. Alguns parasitas na circulação sangüínea diferenciam-se em gametócitos, que são a forma infectiva para o mosquito vetor, onde ocorre o ciclo sexuado. No intestino do mosquito ocorre a maturação dos gametócitos, processo denominado gametogênese, que é seguida pela fertilização, com a união de gametas masculino e feminino gerando um zigoto. Este migra e adere ao epitélio do intestino, onde se desenvolve num oocisto. Quando o oocisto rompe, há liberação de esporozoítos, os quais vão até a glândula salivar e são liberados durante a alimentação do mosquito (Figura 1).
SINALIZAÇÃO POR CÁLCIO Como é comum em células eucarióticas o parasita da malária mantém o cálcio intracelular numa concentração muito baixa. Essa baixa concentração é essencial para a sobrevivência por duas razões principais. A primeira é que se o cálcio no interior das células aumentar muito a célula morre. Ao mesmo tempo, como a concentração de cálcio do lado de fora da célula é 10 mil vezes maior do que dentro, a célula utiliza esse gradiente para permitir que pequenas quantidades de cálcio entrem na célula por períodos muito curtos. Esse pequeno aumento de cálcio no interior da célula representa uma forma geral de ativação da célula. Várias funções celulares são controladas por esse aumento de cálcio transiente, desde a contração de células cardíacas até a divisão de células.
Esses conceitos gerais são válidos tanto para um neurônio humano quanto para o parasita da malária. Para que esse sistema funcione duas condições precisam ocorrer: 1) a concentração de cálcio deve ser baixa no interior da célula; 2) a concentração de cálcio do lado de fora da célula precisa ser muito alta. Com relação ao primeiro ponto, os trabalhos na área de biologia molecular e bioquímica demonstraram que o parasita da malária é capaz de manter concentrações baixas de cálcio no seu interior. A análise do genoma do Plasmodium sugere que esses mecanismos podem ser similares aos encontrados em células de mamíferos.
Com relação ao segundo ponto, está bem estabelecido que a concentração de cálcio fora das células de mamífero (ex: sangue) é muito mais alta que no interior da célula. Quando examinamos a situação com relação ao parasita da malária, isso não ocorre, pois o parasita vive dentro do eritrócito. A questão que nos perguntamos é: Como o parasita pode utilizar cálcio como mensageiro se a concentração de cálcio no ambiente em seu redor é tão baixa?
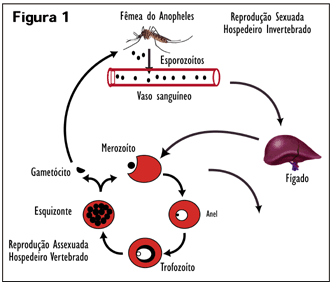
Já é conhecido que o parasita da malária não está livre dentro do eritrócito, mas envolto por uma membrana que, pelo menos em parte, é proveniente da membrana do eritrócito. Experimentamos a hipótese de que o artifício inventado pelo parasita da malária para viver dentro do eritrócito reside na natureza e estrutura dessa membrana (chamada membrana do vacúolo parasitóforo – MVP). Mais precisamente, a nossa hipótese é de que a MVP encapsule o parasita e crie ao redor dele um espaço pequeno mas essencial de concentração de cálcio elevada. Esse envelope assegura que o parasita da malária seja constantemente exposto a alta concentração de cálcio e utilize o íon como um sinalizador. Para provar essa hipótese, colocamos moléculas fluorescentes nesse espaço, as quais mudam de cor dependendo da concentração de cálcio. Através da utilização de microscopia confocal, medimos a intensidade de fluorescência dessas moléculas e demonstramos que este pequeno espaço encapsulado pela MVP contém de fato uma alta concentração de cálcio, como previsto pela nossa hipótese (Figura 2); (3 e 4).
O SEQÜESTRADOR DE BOMBAS O Plasmodium infecta eritrócitos e estes possuem em sua membrana um sistema para jogar cálcio para fora das células. Esse sistema é composto por uma bomba de cálcio conhecida como Ca2+ ATPase, que é uma proteína que utiliza energia proveniente do ATP para retirar cálcio de dentro das células. Quando o parasita invade o eritrócito, a membrana do eritrócito é invertida e com isso algumas dessas bombas que permanecem na membrana que envolve o parasita (MVP) passam a bombear o cálcio do citoplasma para dentro desse pequeno espaço em volta do parasita. Através desse artifício, o parasita encontrou uma forma de resolver um problema importante, e sobreviver dentro de uma outra célula. A revista Nature destacou este trabalho na seção News and Views (5).
Além disso, no artigo do J. Cell Biology (4) demonstramos que se reduzirmos o cálcio experimentalmente no espaço do PVM, o desenvolvimento do parasita é interrompido. Esses resultados são relevantes para entendermos os mecanismos utilizados pelo parasita para sobrevivência dentro do eritrócito bem como quais características do parasita são importantes para essa sobrevivência. Essa estratégia também pode ser utilizada por outros parasitas, além do Plasmodium. Essa hipótese pode ser testada com uma série relativamente simples de experimentos.
SINCRONIZAÇÃO DE PARASITAS Uma característica notável do ciclo de vida de diversas espécies de Plasmodium é sua sincronização. A marcada periodicidade na formação dos gametócitos, as formas sexuadas do parasita, tem sido observada desde o início do século passado. Desta forma, o ritmo circadiano de gametócitos deve ser uma importante adaptação para manutenção do ciclo sexuado do parasita no mosquito vetor.
Demonstramos anteriormente que o parasita da malária utiliza um hormônio humano chamado melatonina, para sincronizar a sua divisão celular (6). A dependência da melatonina, que é produzida ritmicamente, explica um dos mais típicos sintomas da malária: acessos de febre rítmicos, que ocorrem em períodos de tempo múltiplos de 24 horas, também conhecidos por febres terçãs e quartãs (a cada 48 ou 72 horas, respectivamente). O sinal do hormônio melatonina no parasita ocorre através do aumento transiente de cálcio. O artigo Gazarini et al (3) resolve a questão que permanecia em aberto após esse estudo inicial: como o parasita utiliza um sinal de cálcio sem ter o íon em sua volta?
Célia Regina da Silva Garcia é professora titular do Departamento de Fisiologia - Instituto de Biociências da USP.
Referências bibliográficas:
1. Garcia, C.R.S. "Calcium Signaling in the Blood Stage Malaria Parasite" Parasitology Today 15, (12) 488-491, 1999
2. Varotti, F., Beraldo, F.H., Gazarini, M. and Garcia, C.R.S. "Plasmodium falciparum parasites display a thapsigargin-sensitive Ca2+ pool". Cell Calcium 33 , 137-144, 2003.
3. Gazarini, M., Thomas, A., Pozzan, T. and Garcia, C.R.S. "Survival in a low calcium environment: How intracellular parasites such as Plasmodia have solved the problem". J. Cell Biol 161, 103-110, 2003
4. Camacho, P. "Malaria parasites solve the problem of a low calcium environment" J. Cell Biol. 161, 17-19, 2003.
5. "Pump hijacker". Nature vol 423, pag 30, maio 2003.
6. Hotta, C.T., Gazarini, M.L., Beraldo, F.H., Varotti, F.P., Lopes, C., Markus, R.P., Pozzan, T. and Garcia, C.R.S. "Calcium-dependent modulation by melatonin of the circadian rhythms in malaria parasites". Nature Cell Biology, 2, 466-468, 2000.