Services on Demand
Journal
Article
Indicators
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO
Share
Ciência e Cultura
Print version ISSN 0009-6725
Cienc. Cult. vol.63 no.1 São Paulo Jan. 2011
http://dx.doi.org/10.21800/S0009-67252011000100011

Recentes avanços no estudo das enzimas que hidronisam o ATP extracelular
Ana Maria Oliveira Battastini
Rafael Fernandes Zanin
Elizandra Braganhol
ATP: A MOEDA ENERGÉTICA DAS CÉLULAS Os seres vivos que habitam nosso planeta compartilham um conjunto de características comuns que os distinguem da matéria não viva. Dentre essas características, podemos citar: a) um preciso tipo de organização; b) habilidade em manter um meio interno adequado frente a variações do meio externo (homeostasia); c) capacidade de movimentação; d) reatividade a determinados estímulos; e) crescimento, desenvolvimento e reprodução, dentre outras. Para manter as características citadas, os organismos vivos precisam contar com uma fonte contínua de energia. Em outras palavras, toda e qualquer atividade de uma célula ou organismo vivo requer energia. A energia flui desde sua fonte original – o sol – para os seres vivos e, daí, entre as células individuais. A vida na Terra depende de uma constante absorção de energia do sol e, se privada dessa energia, a vida para. Há, portanto, uma interdependência entre os seres vivos e o meio ambiente e entre os próprios seres vivos para obtenção dessa energia. Como sabemos, os seres vivos diferem quanto à forma de obtenção de energia. De uma maneira simplificada podemos dizer que existem os seres produtores (autotróficos), os quais obtêm energia diretamente do sol, transformam essa energia e a "armazenam" na forma de moléculas orgânicas através da fotossíntese; e os seres heterotróficos (consumidores), que dependem dos autotróficos para obter energia na forma dessasmoléculas orgânicasricasemenergia.Amoeda "transferidora" de energia em todos os seres vivos é a adenosina-5'-trifosfato (ATP), um nucleotídeo derivado da adenina (Figura 1). O metabolismo celular é o conjunto de reações químicas (bioquímicas) altamente organizado e regulado que habilita os seres vivos a transformar e utilizar as diferentes formas de energia obtidas do ambiente, através, na grande maioria das vezes, do ATP como intermediário transferidor de energia. Assim, o ATP, presente em todas as células vivas, é reconhecido pelo seu papel intracelular no metabolismo energético. As células continuamente produzem ATP por processos que envolvem a ligação do fosfato inorgânico (Pi) ao ADP e que requerem uma fonte de energia. Por sua vez, a energia do ATP é transferida para os diferentes processos biológicos (síntese de biomoléculas, contração muscular, transporte de íons etc) através da hidrólise de seu fosfato terminal, o que gera um contínuo ciclo de síntese e degradação do ATP (Figura 1). É importante ressaltar que o ADP, produto da hidrólise do ATP, também pode ser hidrolisado, gerando AMP, o qual podegeraronucleosídeoadenosina.Aadenosinapodeserreutilizada, dando origem a novas moléculas de ATP ou, por uma sequência de reações enzimáticas, ser levada à rota de degradação das purinas (1). Sem essa fonte primordial e imediata de energia (ATP), as células não sobrevivem e, assim sendo, a observação e subsequente aceitação de um possível papel para o ATP fora da célula pareceu muito pouco provável durante décadas.
ATO COMO MENSAGEIRO CELULAR O primeiro relato, envolvendo as ações extracelulares de nucleotídeos e nucleosídeos da purina, foi descrito em 1929 por Drury e Szent-Györgyi (2) no sistema cardiovascular.Desdeentão,os estudossobreos efeitosdessas moléculasno meio extracelular, em especial do ATP e seu produto de degradação, a adenosina, continuaram avançando. Uma série de outras ações dessas substâncias foi observada em diferentes processos biológicos, incluindotransmissãonervosa,contração muscular,coagulaçãosanguínea, pressão arterial, metabolismo ósseo, câncer, dor, inflamação, entre outros. Assim, após décadas de estudos, ficou claro que o ATP e seus produtos de degradação ADP, AMP e adenosina, assim como outrosnucleotídeosenucleosídeos,constituemumconjuntodemoléculas que agem como mensageiros das células, exercendo, assim, uma variedadede efeitossobre osmaisdiversostecidosesistemas (3). Mas como o ATP é liberado das células? Os nucleotídeos encontram-se presentes em altas concentrações no interior das células quando comparadas ao meio extracelular, o que é característico de moléculas sinalizadoras. Assim, em resposta a diferentes estímulos ou condições, incluindo dano à membrana plasmática das células induzido por hipóxia, isquemia ou inflamação, concentrações crescentes de nucleotídeos podem ser liberadas no meio extracelular. Além dessas formas de liberação, relacionadas principalmente ao dano celular, o ATP pode ser liberado de células intactas por mecanismos fisiológicos, como ocorre, por exemplo, na transmissão nervosa (4). Uma vez liberados no meio extracelular, os nucleotídeos interagem com receptores específicos, os denominados receptores purinérgicos, os quais estabelecem a comunicação denominada "purinérgica" entre as células (3). Essa sinalização é finalizada pela ação de enzimas que hidrolisam os nucleotídeos até os seus respectivos nucleosídeos no meio extracelular, como será apresentado a seguir.
O QUE SÃO ATPASES? ATPases são enzimas que hidrolisam o grupo fosfato terminal do ATP, sendo amplamente distribuídas na natureza com diferentes papéis biológicos. A existência de vários compartimentos no interior das células (organelas e uma rede altamente organizada de membranas) e a manutenção de um equilíbrio de solutos nesses vários compartimentos requerem um mecanismo preciso e constante de suprimento de energia. As chamadas "bombas de prótons" (ATPases) desempenham, nesse contexto, um papel fundamental no provimento dessa energia, essencial para a vida celular. Tais enzimas utilizam a energia liberada da hidrólise do ATP para manter o ativo processo de transporte de solutos através das membranas, bem como para manter o pH dentro dos limites fisiológicos compatíveis com a vida celular. As ATPases intracelulares, ou próton-ATPases, são divididas em três famílias distintas: P, F e V-ATPAses. Na família das P-ATPases ("P" de "phospho-ATPases") identificamos as bombas específicas de transporte de cátions como a Na+, K+-ATPase, a Ca2+-ATPase do retículo sarcoplasmático, a H+/K+-ATPase da mucosagástrica e a H+-ATPase de plantas (5). As F-ATPases (ou FoF1-ATPase) estão presentes na membrana de bactérias e nas mitocôndrias e cloroplastos, tendo sua função relacionada aos processos de síntese de ATP (ATP-sintase). As V-ATPases (ou ATPase-vacuolares) estão presentes em sistemas de membranas intracelulares de células eucarióticas, incluindo vacúolos e ocomplexo de Golgi, entre outros. Elas são responsáveis pela acidificação do interior desses compartimentos, bem como para suprir energia para o processo de transporte que ocorre através de suas membranas. Todas essas enzimas apresentam, como característica comum, o fato de terem seus sítios catalíticos voltados para o espaço intracelular e terem suas funções catalíticas relacionadas a processos de utilização e/ ou transferência de energia (5).
APIRASES OU ECTO-ATPASES: O QUE SÃO? Em1995,umaexcelente revisão sobre as diferentes ATPases foi publicada (6). Nessa revisão, foi apresentada uma nova classe de enzimas, denominadas de ATPases do tipo E-, ou Ecto-ATPases. Hoje se sabe que existe um eficiente sistema constituído por várias enzimas denominadas coletivamente de ectonucleotidases, as quais recebem denominações relativamente complexas e incluem formas ligadas à membrana plasmática das células (ecto-enzimas), com o sítio ativo voltado para o meio extra-celular ou formas enzimáticas secretadas solúveis. Dentre as enzimas associadas às membranas encontramos: as ecto-nucleosídeo-trifosfato-difosfoidrolases (E-NTPDases; apirases), as ecto-nucleotídeo pirofosfatase/fosfodiesterase (E-NPPs), a ecto-adenilato cinase e as ecto-fosfatases alcalinas, as quais são capazes de degradar o ATP e o ADP até AMP. Finalmente, a ecto-5'-nucleotidase/CD73 (5'-NT/ CD73),enzima marca-passo da rota de degradação dos nucleotídeos, e que hidrolisa o AMP até adenosina. Através de reações sucessivas, essas enzimas constituem uma cascata enzimática altamente eficiente, capaz de controlar a concentração e o tempo em que o ATP e seus derivados permanecem no espaço extracelular (Figura 2) (7; 8). Além do controle da sinalização purinérgica, as ecto-nucleotidases garantem uma "via de salvação" ou de recuperação das purinas, uma vez que os nucleotídeos não retornam ao interior das células sem antes terem seus fosfatos terminais retirados. Dessa forma, após a ação dessas enzimas, o nucleosídeo adenosina pode ser captado pelas células através de transportadores específicos, o que garante a reutilização dessa molécula para a síntese de ATP intracelular.
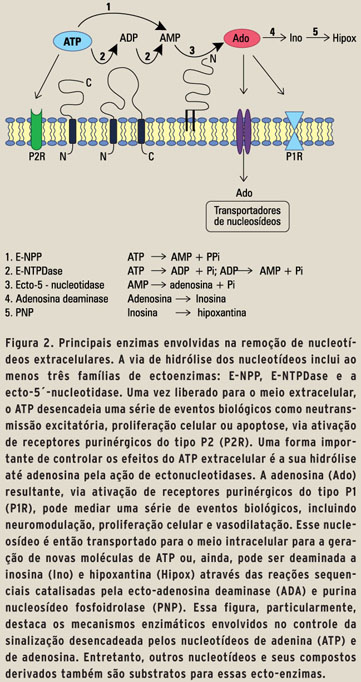
Conforme mostra a figura 2, a primeira etapa de hidrólise do ATP pode ser catalisada por uma família de enzimas, atualmente denominadas de E-NTPDases. De fato, os primeiros estudos sobre essas enzimas coincidem com as primeiras investigações sobre os processos básicos do metabolismo celular, tais como a fermentação em células de leveduras e plantas (9). Em 1945, Meyhorf (10) denominou essa classe de enzimas como "apirases" (de adenilpirofosfatase), pelo fato das mesmas hidrolisarem os dois fosfatos do ATP, produzindo AMP, ao contrário das ATPases, que hidrolisam apenas o fosfato terminal da molécula. Desde então, inúmeras "apirases" foram purificadas e caracterizadas, indicando uma ampla distribuição na natureza, desde vegetais e invertebrados até mamíferos. Entretanto, no mesmo período em que as "apirases" estavam sendo estudadas, foram descritas outras enzimas capazes de hidrolisar o ATP extracelular, as quais foram denominadas de ecto-ATPases (6). Assim, durante muitos anos, houve uma relativa confusão na literatura quanto à natureza química e molecular das enzimas que desempenhavam esse importante papel biológico, até que na década de 1990, estudos moleculares levaram à identificação dos genes que codificam a síntese dessas proteínas. As primeiras caracterizações moleculares das "apirases" ocorreram em 1996, quando experimentos realizados com uma apirase extraída da batata (11) e com a enzima proveniente de diferentes tecidos de mamíferos (12) confirmaram uma homologia estrutural entre essas enzimas. Uma nova nomenclatura foi proposta em 1999, e essa enzima foi identificada como a E-NTPDase1, originalmente classificada como uma ATP-difosfoidrolase e assim denominada na literatura até meados dos anos 1980 (EC 3.6.1.5; apirase) (13).
Em 1997, Kegel e colaboradores demonstraram a coexistência de duas enzimas em vários tipos de células (tecido nervoso, cardíaco renal, entre outros) capazes de hidrolisar de forma diferenciada o ATP. Uma delas hidrolisava o ATP e o ADP com praticamente a mesma velocidade ("apirase") e a outra apresentava uma elevada preferência pelo ATP como substrato, deixando clara a existência de enzimas diferentes na mesma célula capazes de catalisar de forma similar a mesma reação, porém com distinta preferência por substrato.
Hoje se sabe que a família das E-NTPDases não é composta somente por duas enzimas, mas sim por 8 enzimas distintas. Dentro dessa família, as NTPDases1, 2, 3 e 8 são as de maior destaque no que diz respeito ao controle da resposta purinérgica, visto que se encontram ancoradas à membrana plasmática com o sítio catalítico voltado para o meio extracelular ou seja, funcionam como ecto-enzimas (8). As NTPDases5 e 6 têm localização intracelular, mas podem ser encontradas fora da célula na forma solúvel secretada, enquanto que as NTPDases4 e 7 estão localizadas intracelularmente com seus sítios ativos voltados para o lúmen de organelas citoplasmáticas e estão, dessa forma, envolvidas em processos de controle dos níveis de nucleotídeos dentro dessas organelas.
A hidrólise do AMP até adenosina é catalisada pela enzima 5'-nucleotidase. Como mostrado na figura 2, a forma ligada à membrana plasmática (ecto-5'-nucleotidase/CD73) é a principal fonte enzimática de adenosina no meio extracelular (14).
TENDÊNCIAS NO ESTUDO DAS ECTO-NUCLEOTIDASES A história das ecto-nucleotidases nos mostra que, após pouco mais de meio século, as enzimas que hidrolisam o ATP extracelular passaram da condição de simples "artefatos experimentais" sem função biológica definida ao foco de intensa atenção e pesquisa científica. Atualmente, a comunicação celular mediada pelos nucleotídeos e nucleosídeos, assim como a participação das ecto-enzimas envolvidas no controle dessa comunicação, são reconhecidas e intensamente investigadas em diversos sistemas biológicos. Nesse aspecto, podemos identificar estudos importantes dessas enzimas em processos fisiológicos como neurotransmissão, processamento da memória, coagulação sanguínea, contração muscular, controle da pressão arterial, entre outros (8).
Especificamente em relação aos estudos das E-NTPases e ecto-5'-nucleotidases, podemos citar o importante papel das "apirases" presentes na saliva de insetos hematófagos (15;16) e em parasitas (17;18), ficando evidente a importância dos estudos sobre essas enzimas na busca de soluções para doenças que ainda afetam expressiva parcela da população mundial. Além disso, tem chamado atenção a participação desse sistema enzimático na fisiopatologia da dor, no estresse, na imunidade, nos processos infecciosos, em doenças do trato respiratório, doenças inflamatórias e autoimunes, doenças cardiovasculares e câncer (8;19;20).
Em conclusão, os recentes avanços no estudo dessas enzimas revelam a importância dessa área do conhecimento da bioquímica não somente no âmbito da pesquisa pura, mas também com clara e potencial aplicação na investigação das causas e tratamento de inúmeras doenças para as quais ainda não estão disponíveis tratamentos eficientes para sua cura.
Ana Maria Oliveira Battastini é professora do Departamento de Bioquímica, ICBS, da Universidade Federal do Rio Grande do Sul (UFRGS). Pesquisadora 1B do CNPq; coordenadora do grupo de pesquisa "Sistema Purinérgico: receptores e ectonucleotidases em células tumorais e em patologias do sistema nervoso central". Email: abattastini@gmail.com
Rafael Fernandes Zanin é aluno de doutorado do Curso de Pós-Graduação em Ciências Biológicas: Bioquímica, ICBS, UFRGS, Porto Alegre, RS, Brasil. Email: rafaelzaninn@gmail.com
Elizandra Braganhol é bolsista de pós-doutorado (PDJ-CNPq) do Departamento de Bioquímica, ICBS, UFRGS, Porto Alegre, RS, Brasil. Email: elizbraganhol@yahoo.com.br
REFERÊNCIAS BIBLIOGRÁFICAS
1. Nelson, D.L. and Cox, M.M. Principles of biochemistry, 5th Ed. W.H. Freeman and Company, New York. 2008.
2. Drury, A.N. ; Szent-Györgyi, A.. J. Physiol. 68, 213. 1929.
3. Burnstock, G. British J. Pharmacol. 147, S172-S181. 2006.
4. G. Burnstock, Trends in Pharmacol. Sci. 27, 166. 2006.
5. Nelson, N. ; Taiz, L. Trends in Biochem. Sci. 14, 113. 1989.
6. Plesner, L. Int. Rev. Cytol., 158, 141. 1995.
7. Zimermann, H. Drug Dev. Res. 52, 44. 2001.
8. Robson, S.C. et al., Pur. Signal. 2, 409. 2006.
9. Lohmann, K. Biochem Z. 194, 306. 1928.
10. Meyhorf, O. J. Biol. Chem. 157, 105. 1945.
11. Handa, M.; Guidotti, G. Biochem Biophys. Res. Commun. 218, 916. 1996.
12. Kaczmarek, E. et al., J. Biol. Chem. 271, 33116. 1996.
13. Battastini, A.M.O. et al., Neurochem Res. 16, 1303. 1991.
14. Colgan, S.P. et al., Pur. Signal. 2, 351. 2006.
15. Ribeiro, J.M. et al., Comp. Biochem. Physiol. 79B, 81. 1984.
16. Sarkis, J.J.F. et al., Biochem. J. 233, 885. 1986.
17. Tasca, T. et al., Parasitology 131, 71. 2005.
18. Kiffer-Moreira, T. et al., FEMS Yeast Res 10, 735. 2010.
19. Schetinger, M.R.; Morsch, V.M.;. Bonan, C.D. Biofactors 31, 77. 2007.
20. Stagg, J.; Smyth, M.J. Oncogene 29, 5346. 2010.