Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciência e Cultura
versão On-line ISSN 2317-6660
Cienc. Cult. vol.66 no.1 São Paulo 2014
http://dx.doi.org/10.21800/S0009-67252014000100016

Potenciais alvos terapêuticos contra o câncer
Érika C. Alvarenga
Anderson Caires
Luiz O. Ladeira
Edgar J. P. Gamero
Lídia M. Andrade
Miriam T. L. Paz
Maria de Fátima Leite
Desde os primórdios da rádio e da quimioterapia muito se tem investido em estratégias que levem o paciente à cura do câncer. Promissores alvos terapêuticos têm sido desenvolvidos, como alguns fármacos oriundos de produtos naturais e peptídeos sintéticos. Várias frentes de pesquisas no mundo e no Brasil estão em andamento em busca de novas terapias anticâncer, bem como o completo entendimento dos mecanismos de ação dessas terapias na erradicação da doença. Outras vertentes vêm estudando a sinalização intracelular do íon Ca2+ na progressão de células tumorais e mais recentemente o emprego da nanotecnologia no tratamento do câncer desponta para a possibilidade da associação entre terapia fotodinâmica e melhoramento da entrega dirigida de quimioterápicos em células tumorais. Neste artigo são discutidas algumas linhas de pesquisa, desenvolvidas no Brasil, que abordam desde compostos extraídos de plantas até nanotecnologia, identificando inovadores e potenciais alvos para o melhoramento da terapia anticâncer.
PPRODUTOS NATURAIS NA QUIMIOTERAPIA DO CÂNCER No tratamento do câncer as principais terapias utilizadas são a cirurgia, a radioterapia e a quimioterapia citotóxica. Nas últimas décadas a hormonioterapia (utilização de moduladores que inibem a ação de hormônios que agem na proliferação e na diferenciação celular) e a imunoterapia (utilização de anticorpos monoclonais — Mabs), vem ganhando espaço no tratamento das diferentes formas da doença. Dentre os quimioterápicos citotóxicos temos substâncias sintéticas que atuam como alquilantes ou antimetabólitos e substâncias naturais, como os antibióticos citotóxicos originários de microrganismos (fungos) — as antraciclinas e mitomicina C, e derivados de plantas, representados pelos alcalóides da Vinca, taxóis e podofilotoxinas (1). Vários compostos extraídos de produtos naturais, como organismos marinhos (2) e microrganismos (3), vêm sendo estudados quanto às suas atividades antitumorais, e é indiscutível a prevalência de moléculas derivadas de plantas com essa finalidade.
Independente da origem, as classes de quimioterápicos mencionados afetam, por diferentes mecanismos de ação, a proliferação das células (1), o que, devido às semelhanças existentes entre células tumorais e normais, causa grande dificuldade em encontrar alvos de ação seletivos. Além disso, o tratamento do câncer, que comumente é realizado pela associação das diferentes terapias, favorece a erradicação do tumor primário sem, no entanto, mostrar efeito satisfatório sobre a ancoragem de células tumorais em tecidos distantes do tumor primário e o desenvolvimento de metástases (4). Assim, a busca de fármacos que venham a suprir uma ou mais falhas do arsenal quimioterápico atual é incessante.
A capacidade metastática de células tumorais depende da angiogênese, um processo pelo qual o tumor induz a formação de novos vasos sanguíneos, pelo aumento de VEGF (fator de crescimento vascular endotelial, na sigla em inglês), além de outras citocinas, e da motilidade celular, não só das células endoteliais durante a angiogênese, mas também das células tumorais (5). O processo inflamatório, com a característica modulação de seus mediadores, da mesma forma, está diretamente ligado ao processo metastático (6).
Poucos são os fármacos, ou candidatos a fármacos, que vêm despontando como antimetastáticos. Basicamente temos os inibidores de angiogênese (talidomida e alguns azóis) e de metaloproteases como o marimastat (7). Algumas classes de enzimas proteolíticas como as serino-proteases tripsina e quimiotripsina, e cisteíno proteases como bromelaína e papaína, ou combinação destas, tem demonstrado eficácia clínica atuando como supressores tumorigênicos, reduzindo a metástase e aumentando o tempo de sobrevida de pacientes (8;9). Apesar de constatadas as formas de atuação dessas proteases no câncer, os seus mecanismos de ação não estão completamente elucidados. Algumas propostas são apresentadas, incluindo a modulação da expressão de várias moléculas de adesão (10) dos níveis de citocinas (11;12) e das proteínas supressoras tumorais, bem como a redução da expressão de Cox-2 e inibição da via regulada por MAPK (13).
Várias proteínas do tipo cisteíno proteases derivadas do látex da planta Vasconcellea cundinamarcensis (14;15) (Figura 1) vêm sendo descritas como possuidoras de atividade antitumoral, mas, principalmente, antimetastática em modelos animais. Na presença dessas proteases acontece redução da massa do tumor em animais portadores de melanoma (linhagem celular B16F1), de carcinoma inflamatório de mama murino (linhagem celular 4T1) e da celularidade ascítica em roedores portadores de tumor de Ehrlich (16). No modelo de melanoma B16F1, a redução da massa tumoral foi acompanhada pela diminuição dos níveis de hemoglobina e VEGF tumorais. Em modelos metastáticos, as proteases de V. cundinamarcensis diminuíram a ocorrência e o número de metástases pulmonares em animais com melanoma metastático, assim como aumentaram a sobrevida desses animais (17). Quanto ao mecanismo de ação dessas proteases se sabe que algumas delas exercem atividade citotóxica seletiva, aumentando a quantidade de DNA fragmentado por uma via dependente de caspases, diminuindo a adesão celular a diferentes componentes da matriz extracelular, e reduzindo a capacidade de invasão de linhagens celulares tumorais. Bilheiro e cols (18) mostraram que essas proteases possuem atividade anticoagulante, importante característica para um agente antimetastático. Ao que parece, essas proteases promovem alterações nas células tumorais de forma que a atividade antimetastática se expressa em diferentes e sequenciais pontos dos processos de invasão e metástase. Considerando que as proteases do látex de V. cundinamarcensis apresentam baixa toxicidade e não são mutagênicas ou genotóxicas (19;20) nosso grupo de pesquisa vem estudando este princípio ativo visando sua aplicação como alternativa terapêutica, especialmente em tumores metastáticos. A realização de ensaios clínicos para o tratamento do câncer com as proteases de V. cundinamarcensis será conduzido, visto que, atualmente, esse mesmo produto está em teste clínico de fase 2 para o tratamento de feridas, na qual, a sua atividade proteolítica e debridante contribui para a cicatrização. Os resultados até agora alcançados demonstram avanço positivo na geração de possíveis novos agentes farmacológicos na terapia anticâncer, baseados nesses extratos naturais.
PEPTÍDEOS ANTIMICROBIANOS CONTRA O CÂNCER Peptídeos antimicrobianos (PAMs), também chamados de peptídeos de defesa, são produzidos pela maior parte dos organismos. Estes peptídeos possuem atividade inata contra microrganismos no sistema imune em mamíferos (21). A maioria dos peptídeos antimicrobianos são catiônicos, pequenos (até 5-10 kDa) e em muitos casos são anfifílicos e hidrofóbicos, exibindo estruturas diversas. Estudos recentes têm mostrado que seus efeitos citotóxicos poderiam ser benéficos contra as células cancerígenas.
Uma teoria proposta para a ação dos PAMs contra as células cancerígenas é relacionada com a carga positiva de vários deles. É sabido que ocorrem diferenças importantes na membrana plasmática e na matriz extracelular em células tumorais (22-27). Desta forma, a interação eletrostática entre PAMs catiônicos e os componentes aniônicos da membrana pode ser uma característica de seletividade contra células cancerígenas. A interação preferencial dos PAMs catiônicos com células cancerígenas foi demonstrada com os PAMs, BMAP-27 e NK-lysin, dois peptídeos α-hélice anfipáticos (22;24). Ademais, estudo com células CHO-K1 e seu mutante deficiente na biosíntese de glicosaminoglicanos (células CHO-745) mostraram que a presença de heparan sulfato é importante para os efeitos citotóxicos do PAM K5W (25).
Quanto à forma de atuação desses peptídeos esta parece ser bem diversa. Estudos realizados em células, como na linhagem leucêmica aguda humana (HL60), mostraram a potente atividade desses peptídeos. Assim o peptídeo magainina, um PAM anfipático α-hélice, leva à morte por apoptose das células leucêmicas com baixa atividade contra células normais (26;27). Cecropina A, um peptídeo antimicrobiano catiônico, também exibe atividade citotóxica contra as células leucêmicas (HL60) e a eritroleucêmica humana (K562) (28). Num outro estudo, o peptídeo polibia-MPI também mostrou atividade citotóxica por necrose contra essas células leucêmicas e eritroleucêmicas, sem afetar os fibroblastos normais (NIH/3T3). Além disso, foi mostrado que o peptídeo taquiplesina, que possui conformação β-hairpin, por suas pontes de dissulfeto, possui atividade apoptótica contra as células leucêmicas (23;28).
Embora vários estudos tenham mostrado que a atividade antitumoral dos peptídeos antimicrobianos ocorra por necrose e apoptose, os mecanismos de atuação não são totalmente conhecidos (27). O peptídeo gomesina, com estrutura β-hairpin, possui alta atividade citotóxica contra células tumorais e normais (30). O tratamento com gomesina promove a liberação de LDH na linhagem de melanoma murino (B16), devido a isso foi sugerido que a morte celular seja consequência da abertura dos poros na membrana celular ou da ação direta por mecanismos semelhantes aos de um detergente (31-35). Porém, estudos mais recentes mostraram que o mecanismo promovido pela gomesina é bastante complexo. Em células de neuroblastoma humano (SH-SY5Y) e em célula neuronal murina (PC12) foi mostrado que a gomesina produz morte com a participação do íon cálcio (Ca2+) extracelular (35). Ademais, foi verificado que a ação citotóxica desse peptídeo segue uma organizada sequência de morte celular que começa com a entrada do peptídeo na célula, sem permeabilização da membrana, atacando diretamente o retículo endoplasmático, liberando Ca2+, com consequente perda do potencial mitocondrial e ruptura de lisossomos, para posteriormente ocorrer a permeabilização da membrana plasmática (36). Aparentemente, a atividade desse peptídeo é relacionada com sua resistência à degradação devido às pontes de dissulfeto (37;38).
Os PAMs também podem incrementar a citotoxicidade a quimioterápicos convencionais em células cancerígenas (39). A cecropina A, um agente que promove morte celular em leucemia linfoblástica humana com baixa citoxicidade em células normais, aumenta o efeito de drogas quimioterapêuticas como 5-fluorascil (40). Além disso, outros estudos têm demonstrado a atividade imunológica desses peptídeos que são estocados nos grânulos de neutrófilos, mastócitos e células NK (natural killer), embora este aspecto não tenha sido muito aprofundado (26;41;42). Assim, os PAMs também podem ser capazes de induzir seus efeitos direta ou indiretamente no sistema imune por modulação de citocinas (43;44). Os efeitos citotóxicos obtidos com os PAMs em diferentes linhagens leucêmicas indicam esses peptídeos como um novo alvo no tratamento das leucemias.
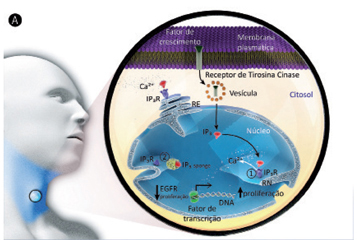
O Ca2+ NUCLEAR NA TERAPIA CONTRA O CÂNCER O Ca2+ é um íon metálico que está presente no organismo em diferentes regiões como nos ossos, na circulação sistêmica, no líquido intersticial (meio extracelular) e também no interior celular. No compartimento intracelular o Ca2+ atua como segundo mensageiro e controla uma variedade de eventos fisiológicos, abrangendo respostas de curta duração como contração muscular e secreção de hormônios, bem como respostas de longa duração como transcrição gênica, proliferação e morte celular, entre outras funções. Embora não seja completamente estabelecido como o Ca2+ coordena tal diversidade de efeitos celulares, vários estudos mostram que a concentração intracelular do Ca2+, bem como o perfil da sinalização e o local onde os sinais do Ca2+ ocorrem, pode determinar a especificidade desse íon a respostas celulares distintas. No interior das células o Ca2+ encontra-se estocado em organelas específicas (retículo endo/sarcoplasmático, mitocôndrias, envelope nuclear e, mais recentemente, também demonstrado no retículo nucleoplasmático) e é liberado para o citoplasma ou para o nucleoplasma, por ação de estímulos extracelulares, que variam entre hormônios, fatores de crescimento, neurotransmissores e até mesmo medicamentos. Mas, para induzir aumento do Ca2+ intracelular, os estímulos extracelulares precisam ativar uma cascata de eventos que inicia com a interação do agonista com seu respectivo receptor localizado na membrana das células. Essa ligação pode promover a ativação de fosfolipase C, que gera inositol-1,4,5-trifosfato (IP3). Este se difunde para o interior celular liberando Ca2+ dos estoques internos, por meio da ativação de canal de Ca2+, por exemplo, do receptor de inositol-1,4,5-trifosfato (IP3R), presente na membrana das organelas armazenadoras de Ca2+ (Figura 2A, parte 1). O Ca2+ liberado é então direcionado para desencadear diversas funções celulares. Assim, os IP3R funcionam como domínios intracelulares reguladores de Ca2+ (revisado por Resende e cols. 2013) (45).
Até recentemente, acreditava-se que a sinalização de Ca2+ no nucleoplasma ocorria por difusão passiva de sinais de Ca2+ do citosol para o núcleo, através de poros presentes no envelope nuclear. No entanto, sabe-se hoje que o núcleo é capaz de liberar e controlar sinais de Ca2+ localmente. Leite e colegas, em 2003 (46; 47), demonstraram que sinais de Ca2+ podem ser gerados no núcleo independente dos sinais de Ca2+ citosólico. Além disso, esse grupo de pesquisadores vem demonstrando que o Ca2+ quando livre no nucleoplasma, regula funções celulares distintas daquelas moduladas pelo Ca2+ citosólico (revisado por 45). Neste aspecto, foi observado em células de adenocarcinoma hepático humano (SkHep1), que o Ca2+ nuclear e não o Ca2+ citosólico regula a proliferação celular (48). Para abordar essa questão foi desenvolvida pelo grupo de pesquisa Leite e cols., uma construção adenoviral que expressa uma proteína quelante de Ca2+, parvalbumina (PV), associada a uma sequência de localização nuclear (NLS), construção esta (Ad-PV-NLS) capaz de tamponar Ca2+ seletivamente no nucleoplasma. Observou-se que o tamponamento do Ca2+ nuclear promove a sincronização das células tumorais no ciclo celular, com parada no início da mitose, especificamente na prófase, reduzindo assim a taxa de crescimento tumoral, sem, contudo, induzir a morte celular por apoptose. Esses achados foram confirmados por ensaios in vivo utilizando implantes de tumores xenográficos de hepatocarcinoma em camundongos (48). Reduzir a taxa de proliferação do tumor e sincronizar as células tumorais na mesma fase do ciclo celular faz da utilização da construção adenoviral Ad-PV-NLS, uma atraente estratégia de terapia gênica a ser testada para o tratamento de doenças crônicas degenerativas, como o câncer.
É sabido que o Ca2+ se liga diretamente ao DNA (46) e que altera a atividade de fatores de transcrição, modulando a expressão gênica (49;50). Foi, portanto, demonstrado que um dos mecanismos pelo qual o Ca2+ nuclear regula a proliferação das células tumorais envolve a alteração na maquinaria de transcrição gênica. Ao tamponar o Ca2+ no núcleo de células de câncer hepático observou-se redução na expressão de genes que codificam para proteínas envolvidas no processo proliferativo, por ação do Ca2+ na região promotora desses genes (51). Esses dados, mais uma vez, indicam o potencial terapêutico do tamponamento do Ca2+ nuclear como terapia contra o câncer.
Baseados nos achados descritos anteriormente, vislumbramos a possibilidade de associar a terapia gênica de tamponamento do Ca2+ nuclear a terapias anticâncer convencionais, como a radioterapia. Um dos tipos de tumores que apresenta alta taxa de recidivas e resistência aos tratamentos convencionais é o câncer de cabeça e pescoço. Esse tipo de câncer é caracterizado pela superexpressão dos receptores para o fator de crescimento epidermal (EGFR), sendo um dos principais entraves para o sucesso terapêutico em carcinomas de células escamosas de cabeça e pescoço nas terapias clássicas, como a radioterapia. Para investigar se o tamponamento do Ca2+ nuclear poderia ser associado como adjuvante à radioterapia foi utilizado como modelo experimental o carcinoma de células escamosas humanas (linhagem celular A431). Para irradiar as células foi padronizado um modelo de irradiação que mimetizasse o protocolo clínico, de doses fracionadas de radiação, semelhante ao usado para tratamento de paciente com câncer de cabeça-pescoço. E para tamponar o Ca2+ nuclear foi utilizada uma construção adenoviral contendo o fragmento que codifica para o sítio de ligação do IP3 ao seu receptor IP3R, fusionado a uma sequência que o direciona à construção para a região nuclear (NLS). Ao ser expresso nas células, essa construção funciona como uma "esponja" (Ad-IP3 sponge-NLS), absorvendo o IP3 gerado intracelularmente e impedindo sua ligação ao receptor endógeno (Figura 2A, parte 2). A figura 2 mostra, esquematicamente, um dos mecanismos como o Ca2+ nuclear interfere na proliferação de células tumorais. Por exemplo, quando o fator de crescimento se liga ao seu receptor na membrana plasmática, esse conjunto é internalizado dentro de uma vesícula que transloca para o núcleo celular. Ocorre então a formação de IP3 nuclear, que se liga a seu sítio de ligação no receptor no IP3R, liberando Ca2+ para o nucleoplasma, o qual modula fatores de transcrição e altera a taxa de proliferação celular. Quando o IP3 gerado é "sequestrado" devido à superexpressão da construção adenoviral Ad-IP3 sponge-NLS, o IP3 não se liga ao seu receptor endógeno e, como consequência, o canal de Ca2+ nuclear não é ativado, não havendo liberação do Ca2+ para o nucleoplasma e, consequentemente, não havendo ativação da maquinaria de proliferação celular.
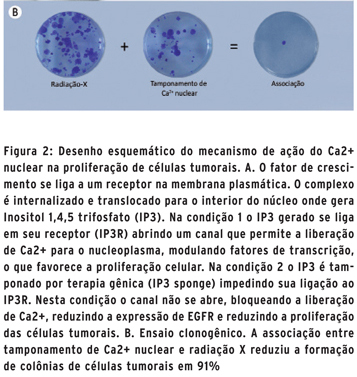
Usando o modelo experimental que associa radioterapia com a terapia gênica foi observado que a associação terapêutica reduziu a taxa de sobrevida das células tumorais em 91% (Figura 2B), o que para um paciente poderia indicar uma chance menor de recidiva tumoral. Além disso, a redução da taxa de sobrevida aconteceu mesmo quando apenas metade da dose usual de radiação X foi associada à terapia gênica. Para o paciente, esse estudo in vitro implicaria em aumento da qualidade de vida, pela redução das complicações pós-radioterapia, tais como mucosite e xerostomia. Os resultados também mostraram que o tamponamento do Ca2+ nuclear reduziu a proliferação somente das células tumorais (A431), não afetando a proliferação de fibroblastos gengivais humanos, indicando seletividade para células tumorais, o que implica em maior segurança da aplicação da técnica para utilização na clínica. É sabido que a radiação ionizante aumenta a expressão de metaloproteinases ADAM-17 que, por seu turno, aumentam a fração livre de ligantes de pró-EGFR. Em decorrência disso, a proliferação celular é estimulada. Porém, o tamponamento do Ca2+ nuclear reduz a superexpressão tanto da ADAM-17 quanto do EGFR, induzidos pela radiação X, indicando que a possibilidade de associar o tamponamento do Ca2+ nuclear com a radiação ionizante uma estratégia terapêutica (52).
Estes dados em cultura celular estão sendo validados em modelo animal, com resultados promissores para motivar etapas pré-clínicas. Além disso, é importante ressaltar que quando se pensa em estratégia para tratamento do câncer, não se pode pensar apenas no tumor primário, mas também na prevenção da metástase. O grupo de pesquisa coordenado por Maria de Fátima Leite na UFMG tem concentrado esforços para verificar a eficiência do tamponamento do Ca2+ nuclear na inibição da migração e invasão de células tumorais. Nesta perspectiva, o tamponamento do Ca2+ nuclear figura como uma estratégia bastante promissora e inovadora para o tratamento do câncer, especialmente na adjuvância de terapias convencionais.
NANOTECNOLOGIA: UMA NOVA FERRAMENTA NA QUIMIOTERAPIA Com os avanços recentes na nanotecnologia, especialmente no tratamento do câncer e na produção de novos medicamentos antitumorais, a ação das nanopartículas como uma inovadora terapia na maximização da destruição tumoral, visa a minimização dos efeitos sistêmicos com baixa toxicidade e tem sido parâmetro importante no sucesso clínico no tratamento contra o câncer. Os progressos realizados na modificação de diversas drogas contra o câncer, usando sistemas de carreadores e técnicas, como ultrassom e laser, têm por objetivo melhorar a entrega dos agentes farmacológicos de modo seletivo aos tumores, favorecendo a aplicação clínica. Os carreadores coloidais bem como lipossomos e nanopartículas são amplamente estudados no sistema de entrega de drogas em células tumorais. Um bom exemplo é a Doxil (Doxorubicina lipossomal) que foi o primeiro agente quimio lipossomal aprovado pelo FDA (Food and Drugs Administration) no tratamento de diversos tipos de tumores como melanoma, câncer de cólon e de mama (53).
Nanomateriais inorgânicos, incluindo nanocristais, nanotubos e nanofios, exibem propriedades físicas que demonstram vantagens nas aplicações biológicas (54). Os nanotubos de carbono (CNT), por exemplo, consistem em uma folha de anéis de carbono enroladas formando uma estrutura tubular, permitindo que estes absorvam radiação próxima do infravermelho resultando em aquecimento local, podendo ser utilizado na destruição seletiva de células cancerígenas (55). Os CNTs também podem ser modificados pela conjugação de ligantes como drogas antitumorais em terapias tumor-específicas (56).
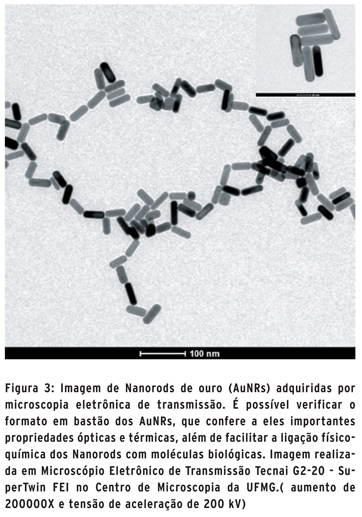
Tanto os CNTs, quanto as nanopartículas de ouro, também chamados de nanorods (AuNR) (Figura 3), apresentam propriedades ópticas e químicas em sua superfície que promovem baixa toxicidade em sistemas biológicos e grande capacidade de se associar a drogas ou moléculas por adsorção ou por ligação química. Os AuNR (57-59) que apresentam essas propriedades, podem ter diversas aplicações como em terapia fototérmica de tumores (60), bioimagem in vivo (61), entrega direcionada de medicamentos (62), biosensores (63), vacinas (64), dentre outras aplicações. As oscilações coletivas de elétrons na superfície dos AuNR devido a suas dimensões nanométricas, fenômeno chamado de plasmon, fazem com que os AuNR se comportem como "nanoantenas", amplificando sinais eletromagnéticos em volta de sua superfície. O fenômeno de plasmon, pode resultar em emissão de luminescência e calor pelos AuNR, sendo estudado como meio de tratamento de câncer na chamada terapia fotodinâmica, em que as células cancerígenas são destruídas pelo aquecimento local gerado pelos AuNR, sem qualquer tipo de droga conjugada a eles (60). As células tumorais, muitas vezes, superexpressam proteínas que são consideradas biomarcadores, fornecendo uma oportunidade de diagnóstico precoce e monitoramento da doença. A detecção de PSA (prostate specific antigen), biomarcador do câncer de próstata, por nanotubos conjugados é um bom exemplo e vem sendo utilizado extensivamente, uma vez que seu limite de detecção supera os imunoensaios comerciais (65).
O uso de nanocarreadores como distribuidor de terapia anticâncer têm sido utilizado no tratamento de melanoma. A associação de nanotubos de carbono single wall (CNTSW) com Doxil reduziu o crescimento tumoral e aumentou a apoptose celular significativamente em células de melanoma murino (B16F10) in vivo, quando comparado ao medicamento sozinho (56). Tal evidência demonstra que as drogas antitumorais e imunoterápicas conjugadas com os CNTs apresentam maior eficácia medicamentosa, pois têm seu efeito potencializado. Em adenocarcinoma mamário murino (células 4T1) tratadas com CNTSW, conjugados com anexinaV (extensivamente expresso em células tumorais), foi observado, após excitação dos CNTSW com laser, indução da ablação térmica promovendo regressão tumoral e sua completa erradicação in vivo (66). Sendo assim, esse sistema de entrega de drogas em células tumorais por CNT, tem sido estudado em diversos tipos de tumores como leucemias (6), câncer de colo uterino e glioblastoma (67).
A terapia gênica associada à nanotecnologia no tratamento do câncer tem se mostrado um ótimo método alternativo à quimioterapia convencional. Os nanotubos podem ser direcionados para essas células usando diferentes estratégias e funcionalizações. Devido ao seu nanotamanho, os nanotubos permitem interações com biomoléculas na superfície celular e suas propriedades não são alteradas no interior da célula, constituindo um método promissor no tratamento do câncer (67).
CONCLUSÕES E PERSPECTIVAS A natureza complexa do câncer ainda não é bem compreendida. A inibição da angiogênese e um melhor entendimento das vias relacionadas com invasão e metástase constituem desafios para o alcance da cura. Apesar das grandes e novas descobertas na terapia anticâncer, ainda são necessários muitos estudos na busca de novos alvos capazes de eliminar o surgimento e a disseminação de focos metastáticos, bloqueando vias críticas para a sobrevivência do tumor. Muitos grupos de pesquisa brasileiros estão investigando novas estratégias que levem tanto à melhor compreensão dos mecanismos de sobrevivência celular quanto à identificação de moléculas chaves, grandes candidatas à terapia anticâncer, explorando diferentes vertentes, desde extratos oriundos de produtos naturais até ao emprego da nanotecnologia, cujos resultados contribuem de forma impactante para o desenvolvimento e surgimento de tratamentos mais eficazes e eficientes, bem como no melhoramento das terapias anticâncer já existentes.
Érika Costa de Alvarenga é fisioterapeuta, mestre e doutora em ciências pela Universidade Federal de São Paulo (Unifesp/EPM) e atualmente pós-doutoranda no Laboratório de Sinalização de Cálcio do Departamento de Fisiologia e Farmacologia da Universidade Federal de Minas Gerais (UFMG), onde desenvolve projetos de pesquisa utilizando nanotecnologia na terapêutica de cânceres.
Anderson Caires é bacharel em física pela UFMG e atualmente aluno de mestrado em física no Laboratório de Nanomateriais do Departamento de Física da UFMG, onde trabalha em pesquisas sobre a aplicação de nanoestruturas plasmônicas em nanomedicina.
Luiz Orlando Ladeira é físico, doutor em física pela UFMG e pós-doutor pelo Center For Advanced Materials Processing Potsdam, Nova Iorque. Atualmente é professor da UFMG, e coordenador do Laboratório de Nanomateriais do Departamento de Física, onde coordena pesquisas na área de nanotecnologia aplicada à nanomedicina.
Edgar Julian Paredes Gamero é biólogo, professor afiliado do Departamento de Bioquímica da Unifesp, professor da Universidade de Mogi das Cruzes (UMC) e orientador do Programa em Biologia Molecular da Unifesp.
Lídia Maria de Andrade é odontóloga e mestre em ciências nucleares pela UFMG, doutoranda em ciências da saúde pelo Centro de Pesquisas René Rachou, Fiocruz-MG.
Miriam Teresa Paz Lopes é biomédica, professora associada do Departamento de Farmacologia, ICB, UFMG, teve sua formação de pós-graduação na Unifesp, foi professora da Faculdade de Medicina da USP e tem como linha de pesquisa a farmacologia de substâncias que afetam o desenvolvimento celular.
Maria de Fátima Leite é farmacêutica, doutora pela University of Chicago e Escola Paulista de Medicina e pós-doutora pela Yale Univesity School of Medicine. É professora associada do Departamento de Fisiologia e Biofísica da UFMG. Coordena o Laboratório de Sinalização de Cálcio. Foi membro da Howard Hughes Medical Institute Fellow e atualmente é pesquisadora 1C do CNPq.
REFERÊNCIAS BIBLIOGRÁFICAS
1. De Almeida, V. L.; Leitão, A.; Reina, L. C. B. et al., Quim. Nova, 28, 118.2005.
2. Sawadogo, W.R.; Schumacher,M.; Teiten, M.H. et al., Molecules, 18, 4.2013.
3. Zhang, J.T. Therapie, 57,2. 2002.
4. Steeg, P.S.;Theodorescu, D. Nat Clin Pract Oncol. 5,4. 2008.
5. Friedl, P., Nat. Rev. Mol. Cell. Biol.10. 2009.
6. Carvalho, J.E. Curr Pharm Des. 18, 26. 2012.
7. Wong, M.S.; Sidik, S.M.; Mahmud, R. et al. Clin Exp Pharmacol Physiol.,40, 5. 2013.
8. Leipner, J. Saller, R. Drugs, 59,4. 2000.
9. Lorkowski, G. Int J Physiol Pathophysiol Pharmacol, 4,1.2012.
10. Guimaraes-Ferreira, C.A.; Rodrigues, E.G.; Mortara, R.A. et al. Neoplasia, 9.2007.
11. Desser, L.; Holomanova, D., Zavadova, E. et al. Cancer Chemotherapy and Pharmacology, 47.2001.
12. Onken, J.E.; Greer, P.K.; Calingaert, B. et al. Clin Immunol, 126. 2008.
13. Bhui, K.P.S.; George, J.; Shukla, Y. Cancer Letters, 282. 2009.
14. Gomes, M. T.; Mello, V. J.; Rodrigues, K. C. et al., Planta Medica. 71. 2005.
15. Teixeira, R.D.; Ribeiro, H.A.; Gomes, M.T. et al., Plant Physiol Biochem, 46, 11. 2008.
16. Lopes, M. T. P.; Dittz, D.; Figueiredo, C. et al., Basic & Clinical Pharmacology & Toxicology,107.2010.
17. Dittz et al., dados não publicados
18. Bilheiro, R.P.; Braga, A.D.; Filho, M.L. et al., Thromb Res. 131, 4. 2013.
19. Villalba, M.; Silva, A.; Tagliati, C. et al., Toxicology Letters, 196,17. 2010.
20. Lemos, F.O.; Ferreira, L.A.; Cardoso, V.N. et al., Eur J Dermatol, 21, 5. 2011.
21. Easton, D.M.; Nijnik, A.; Mayer, M.L. et al. Trends Biotechnol, 27. 2009.
22. Risso, A.; Zanetti, M.; Gennaro, R. Cell Immunol. 189.1998.
23. Chen, J.; Xu, X.M.; Underhill, C.B. et al., Cancer Res., 65. 2005.
24. Schroder-Borm, H.; Bakalova, R.; Andra, J. FEBS Lett., 579. 2005.
25. Fadnes, B.; Rekdal, O.; Uhlin-Hansen, L. BMC Cancer, 9,183. 2009.
26. Wang, J.; Rabenstein, D.L.; Biochim Biophys Acta.1790. 2009.
27. Paredes-Gamero, E.J.; Nogueira-Pedro, A.; Miranda, A. et al. Frontiers in Bioscience, 5. 2013.
28. Matsuzaki, K.; Sugishita, K.; Harada, M. et al., Biochim Biophys Acta, 1327. 1997.
29. Cruz-Chamorro, L.; Puertollano, M.A.; Puertollano, E. et al., Peptides, 27. 2006.
30. Ceron, J.M.; Contreras-Moreno, J.; Puertollano, E. et al., Peptides, 31. 2010.
31. Rodrigues, E.G.; Dobroff, A.S.; Cavarsan, C.F. et al., Neoplasia, 10. 2008.
32. Fazio, M.A.; Oliveira, V.X.; Bulet, P. et al., Biopolymers, 84. 2006.
33. Schaeffer, M.; Miranda, A.; Mottram, J.C. et al., Mol Biochem Parasitol., 150. 2006.
34. Moraes, L.G.; Fazio, M.A.; Vieira, R.F. et al., Biochim Biophys Acta, 1768. 2007.
35. Moreira, C.K.; Rodrigues, F.G.; Ghosh, A. et al.,. Exp Parasitol., 116. 2007.
36. Soletti, R.C.; Del Barrio, L.; Daffre, S ,et al.,. Chem Biol Interact., 186. 2010.
37. Paredes-Gamero, E.J.; Casaes-Rodrigues, R.L.; Moura, G.E. et al., Molecular pharmaceutics, 9. 2012.
38. Buri, M.V.; Domingues, T.M.; Casaes-Rodrigues, R.L. et al., Plos One. Acepted. 2013.
39. Paredes-Gamero, E.J.; Martins, M.N.; Cappabianco, F.A. et al., Biochimica et Biophysica Acta, 1820. 2012.
40. Hoskin, D.W.; Ramamoorthy, A. Biochim Biophys Acta, 1778. 2008.
41. Hui, L.; Leung, K.; Chen, H.M. Anticancer Res., 22. 2002.
42. Lai, Y.; Gallo, R.L. Trends Immunol., 30. 2009.
43. Juarez, J.; Bradstock, K.F.; Gottlieb, D.J. Leukemia, 17. 2003.
44. De Marco, S.J.; Henze, H.; Lederer, A. et al. Bioorg Med Chem.,14. 2006.
45. Resende, R.R.; Andrade, L.M.; Oliveira, A.G. et al.Cell Comm.Signal.,11,14. 2013.
46. Echevarria, W.; Leite, M.F.; Guerra, M.T. et al. Nat Cell Biol 5, 5. 2003.
47. Leite, M.F.; Thrower, E.C.; Echevarria, W. et al., Proc Natl Acad Sci;,100, 5. 2003.
48. Rodrigues, M.A.; Gomes, D.A.; Leite,M.F. et al. JBC, 282, 23. 2007.
49. Thompson, M.; Andrade, V.A.; Andrade, S.J. et al., Biochem Biophys Res Commun, 301, 2. 2003.
50. Puls, T.; Wu, J.J.; Tracy, L. et al., JBC, 277, 30. 2002.
51. Andrade, V.A.; Guerra, M.T.; Jardim, C.A. et al., Journal of Hepatology,11. 2011.
52. Andrade, L.M.; Geraldo, J.M.; Gonçalves, O.X. et al., JCST,14.2012.
53. Nikoobakht, B.; El-Sayed M. A. Method,Chemistry of Materials, 15, 10. 2003.
54. Huang, X.; Neretina, S.; El-Sayed, M. A. Adv. Mater., 21.2009.
55. Anand, G.; Catherine, J. M. Adv. Mater., 16, 19. 2004.
56. Von Maltzahn, G.; Park, J.H.; Agrawal, A. et al., Cancer Res., 69. 2009.
57. Tong, L.; Wei, Q.; Wei, A. et al. Photochemistry and Photobiology, 85. 2009.
58. Tong, L.; Zhao, Y.; Huff, T. B. et al., Adv. Mater., 19. 2007.
59. Xiaohui, W.; Yuan, L.; Huafen, W. et al., Biosensors and Bioelectronics, 26, 2. 2010.
60. Stone, J.W.; Thornburg, N.J.; Blum, D.L. et al., Nanotechnology, 24. 2013.
61. Durr, N.J.; Larson, T.; Smith,D.K. et al. Nano Lett., 7, 4. 2007.
62. Sultana, S.; Khan, M.R.; Kumar, M. et al,. J Drug Target, 21, 2. 2013.
63. Kam, N.W.; Liu, Z.; Dai, H.; J Am Chem Soc., 127, 36. 2005.
64. Firme, C.P.; Bandaru, P.R. Nanomedicine, 6, 2. 2010.
65. Lukas, J.; Aagaard, L.; Strauss, M. et al., Cancer Res., 55, 21. 1995.
66. Castellano ,M.; Parmiani, G., Melanoma Res., 9, 5. 1999.
67. Rosenberg, S.A. Immunity, 10, 3. 1999.